
| A���������м�����������õ������Ի����Һ��c��Na+����c��CH3COO-����c��H+����c��OH-�� |
| B��ij��Ԫ�������ʽ��NaHA��Һ�У�c��H+��+c��Na+��=c��OH-��+c��HA-��+c��A2-�� |
| C��1.0 mol?L -1Na2CO3��Һ��c��OH-��=2c��HCO3-��+c��H+��+c��H2CO3�� |
| D�����ʵ���Ũ����ȵģ�NH4��2SO4��NH4HSO4��NH4Cl��Һ��c��NH4+������NH4��2SO4��NH4HSO4��NH4Cl |


 ����ѵ��ϵ�д�
����ѵ��ϵ�д� ��ĩ�����ϵ�д�
��ĩ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���ڢ� | B���٢� | C���٢� | D���ۢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
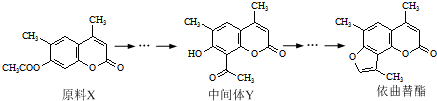
| A��ԭ��X����������ˮ��������м���Y��Ϊͬ���칹�� |
| B��ԭ��X����ʹ����KMnO4��Һ��ɫ |
| C���м���Y�ܷ����ӳɡ�ȡ���������ȷ�Ӧ |
| D��1 mol��������ֻ����1 mol NaOH������Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
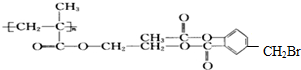 ��NaOH��Һ��Ӧ������NaOH���ʵ������Ϊ��������
��NaOH��Һ��Ӧ������NaOH���ʵ������Ϊ��������| A��4n mol |
| B��5 mol |
| C��5n mol |
| D��6n mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
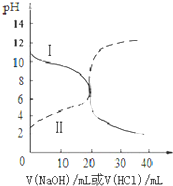 25��ʱ��ȡŨ�Ⱦ�Ϊ0.1mol?L-1�Ĵ�����Һ�Ͱ�ˮ��Һ��20mL���ֱ���Ũ�Ⱦ�Ϊ0.1mol?L-1NaOH��Һ����������к͵ζ����ζ�������pH��μ���Һ������仯��ϵ����ͼ��ʾ������˵������ȷ���ǣ�������
25��ʱ��ȡŨ�Ⱦ�Ϊ0.1mol?L-1�Ĵ�����Һ�Ͱ�ˮ��Һ��20mL���ֱ���Ũ�Ⱦ�Ϊ0.1mol?L-1NaOH��Һ����������к͵ζ����ζ�������pH��μ���Һ������仯��ϵ����ͼ��ʾ������˵������ȷ���ǣ�������| A�����ߢμ���Һ��20 mLʱ��Һ��pH=5��c��H+��-c����NH3?H2O��=c��OH-��=1��10-9 mol?L-1 |
| B�����ߢμ���Һ��20 mLʱ��c��Cl-����c��NH4+����c��H+����c��OH-�� |
| C�����ߢμ���Һ��10 mL��20 mL֮����ڣ�c��NH4+��=c��Cl-����c��OH-��=c��H+�� |
| D�����ߢμ���Һ��10 mLʱ��c��CH3COO-��-c��CH3COOH��=2[c��H+��-c��OH-��] |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
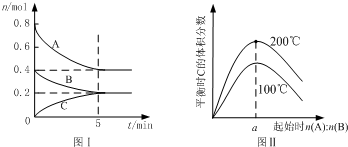
| A������ͼ����ʾ��ƽ��״̬�£�������ϵ�г���He�����´ﵽƽ��ǰv��������v���棩 |
| B��200��ʱ����Ӧ�ӿ�ʼ���պô�ƽ���ƽ������v��B��=0.02 mol?L-1?min-1 |
| C��ͼ����֪��ӦxA��g��+yB��g��?zC��g���ġ�H��0 |
| D��200��ʱ���������г���2 mol A ��1 mol B���ﵽƽ��ʱ��A �������������0.5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
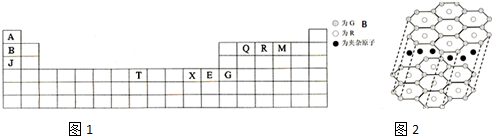
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����������Һ�м���ͭ�ۣ�Ag++Cu=Cu2++Ag |
| B����������Ͷ��ˮ�з�����Ӧ��2O22-+2H2O=4OH-+O2�� |
| C�������ʯ��ˮ��ͨ������������̼��OH-+CO2=HCO3- |
| D����������������������Һ�У�Al+2OH-=AlO2-+H2�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com