

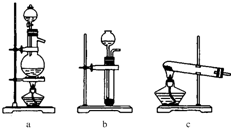

| ||
| △ |
| ||
| △ |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 体积 | ||||
| 反应温度/℃ | 0.1mol?L-1Na2S2O3 | 0.1mol?L-1H2SO4 | H2O | |
| A | 10 | 10 | 10 | 0 |
| B | 10 | 9 | 10 | V1 |
| C | 50 | 8 | 10 | V2 |
| 实验步骤 | 预期现象及结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:
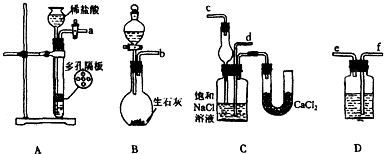
查看答案和解析>>
科目:高中化学 来源: 题型:
| 175℃ |
| △ |
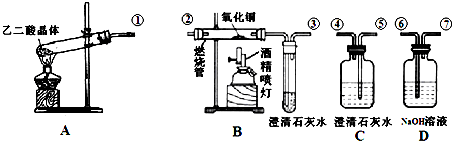
查看答案和解析>>
科目:高中化学 来源: 题型:
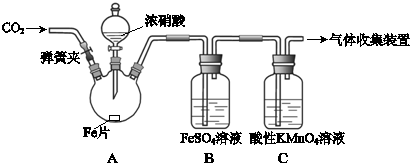
| 实验操作 | 实验现象 |
| 打开弹簧夹,通入一段时间CO2,关闭弹簧夹. | |
| 打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞. | 无明显现象. |
| 加热烧瓶,反应开始后停止加热. | ①A中有红棕色气体产生,一段时间后,气体颜色逐渐变浅; B中溶液变棕色; C中溶液紫色变浅.②反应停止后,A中无固体剩余. |
查看答案和解析>>
科目:高中化学 来源: 题型:
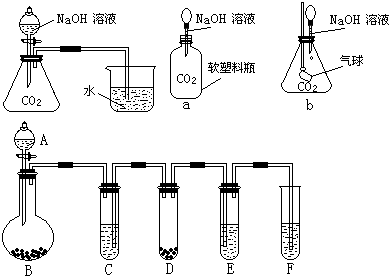
查看答案和解析>>
科目:高中化学 来源: 题型:
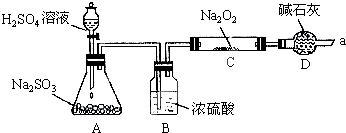
 得出结论:产物是Na2SO4,该方案是否合理
得出结论:产物是Na2SO4,该方案是否合理查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com