

分析 (1)实验里用A装置,加热二氧化锰和浓盐酸反应制取氯气,制得氯气中含有氯化氢和水蒸气,为得到纯净干燥的氯气,要通入饱和食盐水除去氯化氢,通过浓硫酸吸收水蒸气,氯气有毒是污染性气体,不能排放到空气中,需要用氢氧化钠溶液吸收;
(2)喷泉实验利用的原理是压强差,;
(3)喷泉实验需形成明显的压力差;
(4)氯气形成喷泉的原理是由于氯气可溶于水,与氢氧化钠溶液反应,将胶体滴管内液体挤出,氯气和氢氧化钠溶液反应而导致烧瓶内压强迅速减小,从而形成喷泉,依据氯气形成喷泉的原理,如要形成喷泉,烧瓶内气体与胶头滴管内液体反应而导致烧瓶内压强减小,外界大气压将烧杯内液体压入到烧瓶内,从而形成喷泉.
解答 解:(1)用A装置在实验室制备氯气,原理是利用加热二氧化锰和浓盐酸反应制取氯气,制得氯气中含有氯化氢和水蒸气,为得到纯净干燥的氯气,要通入饱和食盐水除去氯化氢,通过浓硫酸吸收水蒸气,氯气有毒是污染性气体,不能排放到空气中,需要用氢氧化钠溶液吸收,反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O;
故答案为:饱和食盐水;浓硫酸;HCl;H2O;NaOH;吸收氯气防止污染环境;Cl2+2NaOH=NaCl+NaClO+H2O;
(2)氯化氢是一种极易溶于水的气体,将胶头滴管中的水挤入烧瓶中,瓶内压强减小,在外界气压的作用下,水被压到瓶内,形成喷泉现象,
故答案为:打开止水夹,挤出胶头滴管中的水;HCl极易溶于水,烧瓶内的压强迅速下降,外界大气压把水压入烧瓶;
(3)HCl是一种极易溶于水的气体,将胶头滴管中的水挤入烧瓶中,瓶内压强减小,在外界气压的作用下,水被压到瓶内,形成喷泉现象,
故答案为:打开止水夹,用手(或热毛巾等)将烧瓶捂热,HCl受热膨胀赶出玻璃管内的空气,与水接触后迅速溶解,使烧瓶内压强减小,就能产生喷泉;
(4)饱氢氧化钠溶液和氯气反应,将胶体滴管内液体挤出,氯气和氢氧化钠溶液反应而导致烧瓶内压强迅速减小,烧瓶内压强减小,能形成喷泉,b、c中应盛的液体为氢氧化钠溶液,
故答案为:氢氧化钠.
点评 本题考查喷泉实验的发生原理,物质性质和喷泉原理的理解应用,掌握基础是关键,题目难度不大,本题注意理解形成喷泉的条件.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| 编号 | 试验目的 | 操作 |
| ① | 比较水中氢和乙醇中羟基氢的活泼性强弱 | 用金属钠分别与同温度的水和乙醇反应,观察反应快慢 |
| ② | 验证苯环上的氢原子能被溴原子所取代 | 向溴水中滴加苯,充分振荡,观察溴水层是否褪色 |
| ③ | 证明SO2具有漂白性 | 将SO2通入酸性KMnO4溶液中,观察溶液是否褪色 |
| ④ | 确定碳和硅两元素非金属性强弱 | 测同温同浓度Na2CO3和Na2SiO3水溶液的PH |
| A. | ①② | B. | ①③ | C. | ①④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
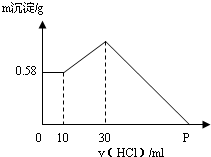 把NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水中后,有0.58g白色沉淀,在所得浊液中逐滴加入0.5mol/L盐酸,加入盐酸体积与生成沉淀的质量关系如图所示.试求:
把NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水中后,有0.58g白色沉淀,在所得浊液中逐滴加入0.5mol/L盐酸,加入盐酸体积与生成沉淀的质量关系如图所示.试求:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等温浓度均为0.1 mol•L-1的HA、HB溶液中,其溶液的pH大小为:pH(HA)>pH(HB) | |
| B. | 在0.1mol•L-1的NaA溶液中各离子浓度关系为:c(Na+)>c(A-)>c(OH-)>c(H+) | |
| C. | 等体积pH相同的HA、HB溶液,分别加入等浓度的NaOH溶液,恰好完全反应消耗的NaOH溶液体积HA比HB多 | |
| D. | 等温浓度均为0.1 mol•L-1的NaA、NaB溶液中,其溶液的pH大小为:pH(NaA)>pH(NaB) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸亚铁溶液与过氧化氢溶液混合Fe2++2H2O2+4H+═Fe3++4H2O | |
| B. | 次氯酸钙溶液中通入少量SO2气体:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| C. | 大理石溶解于醋酸CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | NH4HCO3溶液与足量NaOH溶液混合:NH4++HCO3-+2OH-═NH3•H2O+CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
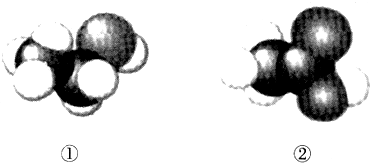
| A. | 二者互为同系物 | B. | 均易溶于水 | ||
| C. | 均能与金属钠反应生成氢气 | D. | 可用紫色石蕊溶液鉴别 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “洁厕灵”(浓盐酸)与“84消毒液”(次氯酸钠)可以混和使用 | |
| B. | 工业上合成氨与实验室制氨气均属于氮的固定 | |
| C. | 由于铝表面有一层致密的氧化物薄膜,所以铝制容器可用来腌制咸菜 | |
| D. | 若铝钠合金投入一定量的水中得无色溶液,则合金中n(Al)≤n(Na) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com