
【题目】A、B两元素的最外层都只有一个电子,A的原子序数等于B的原子序数的11倍,A离子的电子层结构与周期表中非金属性最强的元素的阴离子的电子层结构相同;元素C与B易形成化合物B2C,该化合物常温下呈液态,则:
(1)A的原子结构示意图为____,在固态时属于___晶体。
(2)C的单质属于___晶体。B与C形成化合物B2C的化学式为___,电子式为____;它是由___键形成的___分子,在固态时属于___晶体。
【答案】![]() 金属 分子 H2O
金属 分子 H2O ![]() 极性共价 极性 分子
极性共价 极性 分子
【解析】
由题干信息,A、B两元素的最外层都只有一个电子,A离子的电子层结构与周期表中非金属性最强的元素的阴离子的电子层结构相同,则A为Na元素,A的原子序数等于B的原子序数的11倍,则B为H元素,元素C与B易形成化合物B2C,该化合物常温下呈液态,则C为O元素,据此分析解答。
(1)根据上述分析可知,A为Na元素,其核外有11个电子,原子结构示意图为![]() ,Na在固态时属于金属晶体;
,Na在固态时属于金属晶体;
(2)C为O元素,其单质为O2,属于分子晶体,H与O形成的化合物为H2O,分子中H和O形成共用电子对,其电子式为![]() ,H和O形成极性共价键,因为正负电荷的中心不重合,所以H2O是极性分子,在固态时,H2O属于分子晶体。
,H和O形成极性共价键,因为正负电荷的中心不重合,所以H2O是极性分子,在固态时,H2O属于分子晶体。


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:
【题目】法国格勒诺布尔(![]() )约瑟夫﹒傅立叶大学的研究小组发明了第一块可植入人体为人造器官提供电能的葡萄糖生物燃料电池,其基本原理是葡萄糖和氧气在人体中酶(蛋白质)的作用下发生反应:
)约瑟夫﹒傅立叶大学的研究小组发明了第一块可植入人体为人造器官提供电能的葡萄糖生物燃料电池,其基本原理是葡萄糖和氧气在人体中酶(蛋白质)的作用下发生反应:![]() (酸性环境)。下列有关该电池的说法不正确的是( )
(酸性环境)。下列有关该电池的说法不正确的是( )
A.该生物燃料电池不能在高温下工作
B.该电池负极的电极反应式为![]()
C.消耗1mol氧气时转移4mol电子,![]() 向负极移动
向负极移动
D.提高葡萄糖生物燃料电池的效率,可能使其在将来可以为任何可植入医疗设备提供电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案:
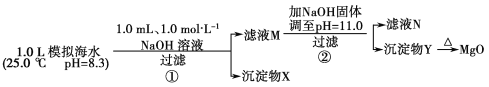
模拟海水中的离子浓度/mol·L-1 | Na+ | Mg2+ | Ca2+ | Cl- | HCO3- |
0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
注:溶液中某种离子的浓度小于1.0×10-5 mol·L-1,可认为该离子不存在;实验过程中,假设溶液体积不变。Ksp[CaCO3]=4.96×10-9,Ksp[MgCO3]=6.82×10-6,Ksp[Ca(OH)2]=4.68×10-6,Ksp[Mg(OH)2]=5.61×10-12。下列说法正确的是( )
A.沉淀物X为CaCO3
B.滤液M中存在Mg2+,不存在Ca2+
C.滤液N中存在Mg2+、Ca2+
D.步骤②中若改为加入4.2 g NaOH固体,沉淀物Y为Ca(OH)2和Mg(OH)2的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系![]() 部分反应中的水已略去
部分反应中的水已略去![]() .
.
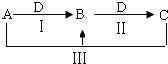
![]() 若A为氯碱工业的产品,C为厨房中的用品.
若A为氯碱工业的产品,C为厨房中的用品.
![]() 的电子式是______.
的电子式是______.
![]() 反应Ⅲ的离子方程式是______.
反应Ⅲ的离子方程式是______.
![]() 氯碱工业制备A的化学方程式是______,其中两种产物可与KI溶液反应制得一种化工原料,若消耗
氯碱工业制备A的化学方程式是______,其中两种产物可与KI溶液反应制得一种化工原料,若消耗![]() KI转移电子
KI转移电子![]() ,则三种物质间反应的离子方程式是______.
,则三种物质间反应的离子方程式是______.
![]() 若A、D均为单质,且A为气体,D元素的一种红棕色氧化物常用作颜料.
若A、D均为单质,且A为气体,D元素的一种红棕色氧化物常用作颜料.
![]() 反应Ⅲ的离子方程式是______.
反应Ⅲ的离子方程式是______.
![]() 可作净水剂,在使用时发现B不能使酸性废水中的悬浮物沉降除去,其原因是______.
可作净水剂,在使用时发现B不能使酸性废水中的悬浮物沉降除去,其原因是______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数值。下列有关叙述正确的是( )
A.14g乙烯和丙烯混合气体中的氢原子数为2NA
B.1mol甲烷中的氢原子被氯原子完全取代,需要氯气分子数为2NA
C.92.0g甘油(丙三醇)中含有羟基数为1.0NA
D.标准状况下,2.24LCCl4含有的共价键数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图所示电化学实验装置图,回答有关问题。
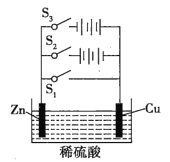
(1)若只闭合S1,该装置属于_______,能量转化形式为_______,锌极作_______极。
(2)若只闭合S2,该装置属于_______,能量转化形式为_______,锌极上的电极反应式为_______。
(3)若只闭合S3,该装置属于_______,铜极作_______极,锌极上的电极反应式为_______,总反应的化学方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数的值为NA,下列说法中正确的是( )
A.1mol苯乙烯![]()
![]()
![]() 中含有的C=C数为4NA
中含有的C=C数为4NA
B.2.8g乙烯和丙烯的混合气体中所含碳原子数为0.2 NA
C.0.1molCnH2n+2中含有的C—C键数为0.1nNA
D.标准状况下,2.24LCHCl3含有的分子数为0.1 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】HCN是一种剧毒性的酸,常温下,0.10molL-1HCN溶液的pH = 3,下列说法正确的是( )
A.HCN是一种强酸
B.相同浓度的NaCl溶液与NaCN溶液,前者的pH更大
C.在NaCN溶液中存在:c(Na+) = c(HCN) + c(CN-)
D.中和相同体积与浓度的HCl溶液与HCN溶液,所消耗的NaOH溶液的体积不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,用0. 100 mol·L—1盐酸滴定50. 0mL Na2CO3溶液(不考虑CO2从溶液中逸出).滴定曲线如图所示:
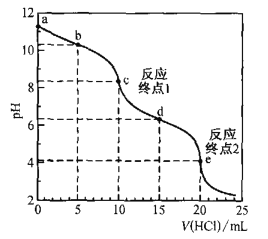
下列说法错误的是
A.a点溶液中:c(Na2CO3)=0.020 mol·L—1
B.b点溶液中:c(Na+)>c(HCO3— )>c(CO32—)
C.c点溶液中:c(Na+)+c(H+)=2c(CO32—) +c(HCO32—)+c(OH—)
D.室温时,H2CO3的一级电离平衡常数Kal的数量级为10—7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com