
 纳米级Cu2O由于具有优良的催化性能而备受关注,下表为制取纳米级Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而备受关注,下表为制取纳米级Cu2O的三种方法: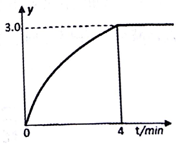
分析 (1)碳粉在高温下易将氧化铜还原为铜单质;
(2)已知:①2Cu(s)+$\frac{1}{2}$O2(g)═Cu2O(s)△H=-akJ•mol-1
②C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-bkJ•mol-1
③Cu(s)+$\frac{1}{2}$O2(g)═CuO(s)△H=-ckJ•mol-1
根据盖斯定律:①+②-2×③可得2CuO(s)+C(s)═Cu2O(s)+CO(g);
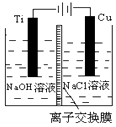
(3)根据在电解池的阳极发生失电子的氧化反应;
(4)根据“液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2”来书写化学方程式;
(5)肼易溶于水,它是与氨类似的弱碱,则电离生成OH-和阳离子;
(6)设平衡时n(N2)=a,n(H2)=2a,
n(N2H4)=0.1 mol-a,则:3a=3.0×(0.1 mol-a),a=0.05 mol,
υ(H2)=$\frac{△c}{△t}$,K=$\frac{c({N}_{2})•{c}^{2}({H}_{2})}{c({N}_{2}{H}_{4})}$计算;
(7)N2H4/空气在碱溶液中构成电池,N2H4在负极上发生氧化反应,O2在正极上发生还原反应,负极的电极反应式为N2H4-4e-+4OH-=N2↑+4H2O,正极反应为:O2+2H2O+4e-=4OH-,电池总反应为:N2H4+O2=N2↑+2H2O,据此判断pH.
解答 解:(1)用炭粉在高温条件下还原CuO制备Cu2O,若温度控制不当,易将CuO还原为Cu单质;
故答案为:Cu;
(2)已知:①2Cu(s)+$\frac{1}{2}$O2(g)═Cu2O(s)△H=-akJ•mol-1
②C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-bkJ•mol-1
③Cu(s)+$\frac{1}{2}$O2(g)═CuO(s)△H=-ckJ•mol-1
根据盖斯定律:①+②-2×③可得2CuO(s)+C(s)═Cu2O(s)+CO(g)△H=-(a+b-2c)kJ/mol;
故答案为:-(a+b-2c)kJ/mol;
(3)在电解池中,当阳极是活泼电极时,该电极本身发生失电子的反应,在碱性环境下,金属铜失去电子的电极反应为2Cu-2e-+2OH-=Cu2O+H2O;
故答案为:①Cu2O;②2Cu-2e-+2OH-=Cu2O+H2O;
(4)根据题目信息:液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,得出化学方程式为:4Cu(OH)2+N2H4$\frac{\underline{\;\;△\;\;}}{\;}$2Cu2O+N2↑+6H2O;
故答案为:4Cu(OH)2+N2H4$\frac{\underline{\;\;△\;\;}}{\;}$2Cu2O+N2↑+6H2O;
(5)肼易溶于水,它是与氨类似的弱碱,则电离生成OH-和阳离子,
电离方程式为N2H4+H2O?N2H5++OH-;
故答案为:N2H4+H2O?N2H5++OH-;
(6)设平衡时n(N2)=a,n(H2)=2a,
n(N2H4)=0.1 mol-a,则:3a=3.0×(0.1 mol-a),a=0.05 mol.
υ(H2)=$\frac{0.05mol×2}{1L×4min}$=0.025mol/(L•min),K=$\frac{c({N}_{2})•{c}^{2}({H}_{2})}{c({N}_{2}{H}_{4})}$=$\frac{(0.05÷1)•(0.05×2÷1)^{2}}{0.1-0.05}$=0.01;
故答案为:0.025;0.01;
(7)根据燃料电池的特点分析,产生环保,电池总反应为N2H4+O2=N2↑+2H2O,燃料在负极失电子发性氧化反应,氧气在正极得电子发生还原反应,在酸性条件下生成水,在碱性条件下生成氢氧根,所以正极反应为:O2+4e-+2H2O═4OH-,总反应减正极得到负极反应式:N2H4+4OH--4e-=4H2O+N2↑,原电池反应生成水,溶液浓度降低,电解质溶液的pH将降低;
故答案为:N2H4+4OH--4e-=4H2O+N2↑;减小.
点评 本题考查较为综合,涉及反应速率、平衡常数、平衡移动、盖斯定律以及电化学等知识,题目难度中等,注意把握电化学原理结合题意判断.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 含碳的化合物之间很容易发生转化.请回答下列问题:
含碳的化合物之间很容易发生转化.请回答下列问题: (l)的燃烧热为 3267.5kJ•mol-1,
(l)的燃烧热为 3267.5kJ•mol-1,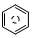 (l)+6O 2(g)═6CO2 (g)+3H2 (g)
(l)+6O 2(g)═6CO2 (g)+3H2 (g)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②③④ | C. | ②⑥ | D. | ①③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
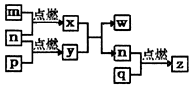 短周期主族元素,a、b、c、d的原子序数依次增大.四种元素形成的单质依次为m、n、p、q时;x、y、z是这些元素组成的二元化合物,其中z为形成酸雨的主要物质之一;25℃0.01mol•L-1w溶液中,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1.0×10-10.上述物质的转化关系如图所示.下列说法正确的是( )
短周期主族元素,a、b、c、d的原子序数依次增大.四种元素形成的单质依次为m、n、p、q时;x、y、z是这些元素组成的二元化合物,其中z为形成酸雨的主要物质之一;25℃0.01mol•L-1w溶液中,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1.0×10-10.上述物质的转化关系如图所示.下列说法正确的是( )| A. | 原子半径的大小:a<b<c<d | B. | 氢化物的沸点:b>d | ||
| C. | x的电子式为: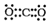 | D. | z、w含有的化学键类型完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
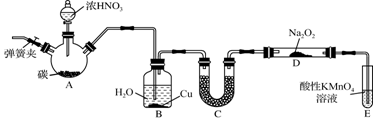
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 测定时刻/s | t1 | t2 | t3 | t4 |
| c(A)/(mol•L-1) | 6 | 3 | 2 | 2 |
| c(B)/(mol•L-1) | 5 | 3.5 | 3 | 3 |
| c(C)/(mol•L-1) | 1 | 2.5 | 3 | 3 |
| A. | 在t3时刻反应已经停止 | |
| B. | A的转化率比B的转化率低 | |
| C. | t1至t2时刻该反应的速率为3mo1•L-1•s-1 | |
| D. | 该反应的化学方程式为2A(g)+B(g)?C(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
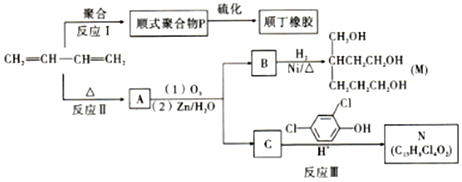
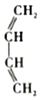 +
+ $\stackrel{△}{→}$
$\stackrel{△}{→}$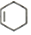
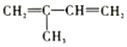 的名称是2-甲基-1,3-丁二烯.
的名称是2-甲基-1,3-丁二烯. b.
b. c.
c.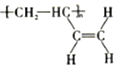
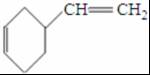 ;反应III的化学方程式是
;反应III的化学方程式是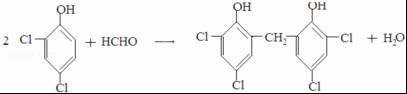 ;1molB完全转化成M所消耗H2的质量是6g.
;1molB完全转化成M所消耗H2的质量是6g.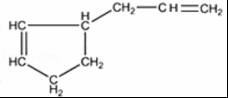 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com