
 分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用图1表示:
分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用图1表示: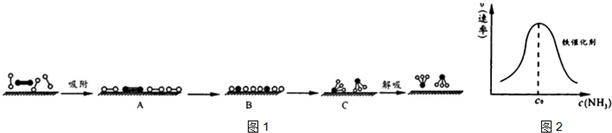
分析 (1)①化学键的断裂要吸收能量,且该反应放热;
②c0前氨的浓度增加,导致反应速率加快;c0后由于氨分子浓度太大阻碍N2和H2的解吸;
(2)根据二氧化锰有氧化性,将过氧化氢氧化生成氧气,生成的锰离子又3被过氧化氢氧化到+4价的二氧化锰;
(3)设氮气氢气的初始量为1mol,反应氮气x,根据三段式计算平衡时各物质的量,计算氮气的体积分数.
解答 解:(1)①由于化学键的断裂要吸收能量,故活化状态B的能量高于初始状态A的能量,而此反应为放热反应,故初始状态A的能量高于末态C的能量,故C的能量最低;
故答案为:C;
②c0前氨的浓度增加,导致反应速率加快;c0后由于氨分子浓度太大阻碍N2和H2的解吸,故反应速率减慢;
故答案为:随着气相NH3浓度的增加,催化剂的吸附率升高,固相NH3浓度增加,NH3的分解速率加快;催化剂吸附达到饱和,同时不利于解吸,NH3的分解速率降低;
(2)二氧化锰有氧化性,将过氧化氢氧化生成氧气,生成的锰离子又3被过氧化氢氧化到+4价的二氧化锰,所以反应为:MnO2+H2O2+2H+=Mn2++2H2O+O2↑; Mn2++H2O2=MnO2↓+2H+;
故答案为:MnO2+H2O2+2H+=Mn2++2H2O+O2↑; Mn2++H2O2=MnO2↓+2H+
(3)设氮气氢气的初始量为1mol,反应氮气x,根据三段式:
N2(g)+3H2(g)?2NH3(g)
起始量(mol):1 1 0
转化量(mol):x 3x 2x
平衡量(mol):1-x 1-3x 2x
则N2的体积分数为$\frac{1-x}{1-x+1-3x+2x}$×100%=$\frac{1-x}{2×(1-x)}$×100%=50%;
答案为:50%.
点评 本题考查化学平衡计算、催化剂在反应中的作用,侧重考查学生分析计算能力,正确解读题目给出的信息是解决信息性题目的关键,要善于从信息中捕捉最有效的信息用来处理问题题目,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.1mol Na2O2与足量CO2反应转移的电子的物质的量为0.1mol | |
| B. | 将Na2O2粉末加入到饱和NaOH溶液中,OH-离子浓度一定不变 | |
| C. | 等物质的量的Na2O2与Na2O溶于等质量水中得到的NaOH的物质的量浓度相同 | |
| D. | 等质量的Na2O2与Na2S晶体中含有相同数目的阴离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 人体缺碘,可通过食用加碘盐补碘 | |
| B. | 为了防止龋齿,人人都要使用含氟牙膏 | |
| C. | 缺铁性贫血,可通过食用铁强化酱油预防 | |
| D. | 儿童缺锌可导致生长发育不良,抵抗力差,食欲不振 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
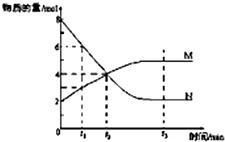 一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图,依图所示:
一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图,依图所示:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 化学键 | H-H | C-O | C≡O (CO中的化学键) | H-O | C-H |
| E/(kJ/mol) | 436 | 343 | 1076 | 465 | 413 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/min | 0 | 1 | 3 | 5 | 9 | 10 | 14 |
| X/mol | 1.00 | 0.90 | 0.75 | 0.65 | 0.55 | 0.55 | 0.55 |
| Y/mol | 1.00 | 0.80 | 0.50 | 0.30 | 0.10 | 0.10 | 0.10 |
| Z/mol | 0.00 | 0.20 | 0.50 | 0.70 | 0.90 | 0.90 | 0.90 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 未冷却即转移、定容 | B. | 溶液转移后,未洗涤烧杯和玻璃棒 | ||
| C. | 定容时俯视刻度线 | D. | 容量瓶中原有少量蒸馏水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com