
ЁОЬтФПЁПAЁЋHЗжБ№БэЪОжабЇЛЏбЇжаГЃМћЕФФГжжЮяжЪЃЌЫќУЧжЎМфЕФЯрЛЅзЊЛЏЙиЯЕШчЯТЭМЫљЪО(ВПЗжЗДгІЮяЁЂЩњГЩЮяЮДСаГі)ЁЃвбжЊЃКCЁЂDЁЂEЁЂFЁЂGЮхжжЮяжЪжаОљКЌгаЭЌвЛжждЊЫиЃЛAЮЊЕЛЦЩЋЙЬЬхЛЏКЯЮяЃЛGЮЊКьКжЩЋЙЬЬхЁЃ

(1)аДГіЛЏбЇЪНЃКAЃК________________ЃЛCЃК________________ЃЛFЃК________________ЁЃ
(2)аДГіЗДгІЕФЛЏбЇЗНГЬЪНЃК
Ђк_____________________________________________________________ЁЃ
Ђо_____________________________________________________________ЁЃ
(3)аДГіРызгЗНГЬЪНЃК
Ђл_____________________________________________________________ЁЃ
Ђн_____________________________________________________________ЁЃ
(4)ЩњГЩ24 g BашвЊзЊвЦ________molЕчзгЁЃ
ЁОД№АИЁПNa2O2Fe3O4Fe(OH)22O2ЃЋ3Fe![]() Fe3O44Fe(OH)2ЃЋO2ЃЋ2H2O===4Fe(OH)3Fe3O4ЃЋ8HЃЋ===Fe2ЃЋЃЋ2Fe3ЃЋЃЋ4H2OFe3ЃЋЃЋ3OHЃ===Fe(OH)3Ё§1.5
Fe3O44Fe(OH)2ЃЋO2ЃЋ2H2O===4Fe(OH)3Fe3O4ЃЋ8HЃЋ===Fe2ЃЋЃЋ2Fe3ЃЋЃЋ4H2OFe3ЃЋЃЋ3OHЃ===Fe(OH)3Ё§1.5
ЁОНтЮіЁП
CЁЂDЁЂEЁЂFЁЂGжаОљКЌгаЭЌвЛжждЊЫиЃЌGЮЊКьКжЩЋЙЬЬхЃЌЧвDКЭOH-ЗДгІЩњГЩFЃЌFдкПеЦјжаЗХжУЩњГЩЕФGЃЌПЩХаЖЯGЮЊFe(OH)3ЃЌFЮЊFe(OH)2ЃЌDЪЧКЌгабЧЬњРызгЕФПЩШмадбЮЁЃAЮЊЕЛЦЩЋЙЬЬхЛЏКЯЮяЃЌAЮЊNa2O2ЃЌBЮЊO2ЃЌHЮЊNaOHЃЌHгыEЗДгІЩњГЩGЃЌдђEЪЧКЌгаЬњРызгЕФПЩШмадбЮЁЃCзЊЛЏЮЊDгыEЃЌBзЊЛЏЮЊCЃЌдђCЪЧЫФбѕЛЏШ§ЬњЃЌDПЩвдЪЧFeCl2ЃЌEПЩвдЪЧFeCl3ЃЌОнДЫНтД№ЁЃ
ИљОнвдЩЯЗжЮіПЩжЊAЮЊNa2O2ЃЌBЮЊO2ЃЌCЪЧЫФбѕЛЏШ§ЬњЃЌDПЩвдЪЧFeCl2ЃЌEПЩвдЪЧFeCl3ЃЌFЮЊFe(OH)2ЃЌGЮЊFe(OH)3ЃЌHЮЊNaOHЃЌдђ
ЃЈ1ЃЉAЁЂCЁЂFЕФЛЏбЇЪНЗжБ№ЪЧNa2O2ЁЂFe3O4ЁЂFe(OH)2ЁЃ
ЃЈ2ЃЉЗДгІЂкЕФЗНГЬЪНЮЊ2O2ЃЋ3Fe![]() Fe3O4ЃЛЗДгІЂоЕФЗНГЬЪНЮЊ4Fe(OH)2ЃЋO2ЃЋ2H2OЃН4Fe(OH)3ЃЛ
Fe3O4ЃЛЗДгІЂоЕФЗНГЬЪНЮЊ4Fe(OH)2ЃЋO2ЃЋ2H2OЃН4Fe(OH)3ЃЛ
ЃЈ3ЃЉЗДгІЂлЕФРызгЗНГЬЪНЮЊFe3O4ЃЋ8HЃЋЃНFe2ЃЋЃЋ2Fe3ЃЋЃЋ4H2OЃЛЗДгІЂнЕФРызгЗНГЬЪНЮЊFe3ЃЋЃЋ3OHЃЃНFe(OH)3Ё§ЁЃ
ЃЈ4ЃЉЩњГЩBЕФЗДгІЮЊ2Na2O2+2H2OЃН4NaOH+O2ЁќЃЌЙ§бѕЛЏФЦжабѕЮЊ-1МлЃЌбѕЦјжабѕЮЊ0МлЃЌЙЪУПЩњГЩ1molO2зЊвЦ2molЕчзгЃЌШєЩњГЩ24gбѕЦјЃЌбѕЦјЕФЮяжЪЕФСПЪЧ24gЁТ32g/molЃН0.75molЃЌдђзЊвЦЕчзгЕФЮяжЪЕФСПЪЧ0.75molЁС2ЃН1.5molЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯђ0ЃЎlmol/L NaOHШмвКжаЭЈШыЙ§СПЕФCO2КѓЃЌШмвКжаДцдкЕФжївЊРызгЪЧЃЈ ЃЉ
A.Na+ЁЂCO32Љ
B.Na+ЁЂHCO3Љ
C.CO32ЉЁЂHCO3Љ
D.Na+ЁЂOHЉ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПH2O2ЪЧвЛжжГЃМћЪдМСЃЌдкЪЕбщЪвЁЂЙЄвЕЩњВњЩЯгаЙуЗКгУЭО

Ђё.ЪЕбщЪвгУH2O2ПьЫйжЦбѕЃЌЦфЗжНтЫйТЪЪмЖржжвђЫигАЯьЁЃЪЕбщВтЕУ70ЁцЪБВЛЭЌЬѕМўЯТH2O2ХЈЖШЫцЪБМфЕФБфЛЏШчМзввБћЖЁЫФЭМЫљЪОЃК
ЃЈ1ЃЉЯТСаЫЕЗЈе§ШЗЕФЪЧЃК________ЃЈЬюзжФИађКХЃЉ
AЃЎЭММзБэУїЃЌЦфЫћЬѕМўЯрЭЌЪБЃЌH2O2ХЈЖШдНаЁЃЌЦфЗжНтЫйТЪдНТ§
BЃЎЭМввБэУїЃЌЦфЫћЬѕМўЯрЭЌЪБЃЌШмвКМюаддНШѕЃЌH2O2ЗжНтЫйТЪдНПь
CЃЎЭМБћБэУїЃЌЩйСПMn 2+ДцдкЪБЃЌШмвКМюаддНЧПЃЌH2O2ЗжНтЫйТЪдНПь
DЃЎЭМБћКЭЭМЖЁБэУїЃЌМюадШмвКжаЃЌMn2+ЖдH2O2ЗжНтЫйТЪЕФгАЯьДѓ
ЃЈ2ЃЉДпЛЏМСMn2+дкЗДгІжаЃЌИФБфСЫ____________________(ЬюзжФИађКХ)
AЃЎЗДгІЫйТЪ BЃЎЗДгІЯоЖШCЃЎЗДгІьЪБф DЃЎЗДгІТЗОЖ
E.ЗДгІЛюЛЏФм F.ЛюЛЏЗжзгАйЗжЪ§
Ђђ. H2O2дкЙЄвЕЩЯзїЮЊFentonЗЈжївЊЪдМСЃЌГЃгУгкДІРэКЌФбНЕНтгаЛњЮяЕФЙЄвЕЗЯЫЎЁЃдкЕїНкКУpHЃЈШмвКЕФЫсМюадЃЉКЭFe2+ХЈЖШЕФЗЯЫЎжаМгШыH2O2ЃЌЫљВњЩњЕФєЧЛљздгЩЛљФмбѕЛЏНЕНтЮлШОЮяЁЃЯждЫгУИУЗНЗЈНЕНтгаЛњЮлШОЮяp-CPЃЌЬНОПгаЙивђЫиЖдИУНЕНтЗДгІЫйТЪЕФгАЯьЁЃ
ЁОЪЕбщЩшМЦЁППижЦp-CPЕФГѕЪМХЈЖШЯрЭЌЃЌКуЖЈЪЕбщЮТЖШдк298KЛђ313KЃЈЦфгрЪЕбщЬѕМўМћЯТБэЃЉЃЌЩшМЦШчЯТЖдБШЪдбщЃЌВЂНЋЪЕбщНсЙћЛцжЦЪБМф-p-CPХЈЖШЭМШчЯТЁЃ

ЃЈ3ЃЉЕчжаадЕФєЧЛљздгЩЛљЕФЕчзгЪНЮЊЃК______________
ЃЈ4ЃЉЧыЭъГЩвдЯТЪЕбщЩшМЦБэ(БэжаВЛвЊСєПеИё)ЁЃ
ЪЕбщ БрКХ | ЪЕбщФПЕФ | T/K | pH | c/10-3molЁЄL-1 | |
H2O2 | Fe2+ | ||||
Ђй | ЮЊвдЯТЪЕбщзїВЮПМ | 298 | 3 | 6.0 | 0.30 |
Ђк | ЬНОПЮТЖШЖдНЕНтЗДгІЫйТЪЕФгАЯь | _________ | ______ | _______ | _________ |
Ђл | __________________ | <>298 | 10 | 6.0 | 0.30 |
ЃЈ5ЃЉЧыИљОнгвЩЯЭМЪЕбщЂйЧњЯпЃЌМЦЫуНЕНтЗДгІдк50ЁЋ150sФкЕФЗДгІЫйТЪЃКv(p-CP)=_____________
ЃЈ6ЃЉЪЕбщЪБашдкВЛЭЌЪБМфДгЗДгІЦїжаШЁбљЃЌВЂЪЙЫљШЁбљЦЗжаЕФЗДгІСЂМДЭЃжЙЯТРДЁЃИљОнЪЕбщНсЙћЃЌИјГівЛжжбИЫйЭЃжЙЗДгІЕФЗНЗЈЃК__________________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЩшNAЮЊАЂЗќМгЕТТоГЃЪ§ЕФжЕЃЌЯТСаа№Ъіе§ШЗЕФЪЧ
A. 0.1mol/LДзЫсШмвКжаКЌгаДзЫсЗжзгЕФЪ§ФПЮЊ0.1NA
B. 25ЁцЪБЃЌ1LpH=12ЕФNa2CO3ШмвКжаКЌгаNa+ЕФЪ§ФПЮЊ0.2NA
C. ГЃЮТЯТЃЌ20LpH=12ЕФNa2CO3ШмвКжаКЌгаOH-Ъ§ФПЮЊ0.2NA
D. ФГУмБеШнЦїЪЂга0.1molN2КЭ0.3molH2ЃЌдквЛЖЈЬѕМўЯТГфЗжЗДгІ,зЊвЦЕчзгЪ§ФПЮЊ0.6NA
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдкШнЛ§вЛЖЈЕФУмБеЦїжаЗЂЩњПЩФцЗДгІЃКA(g)+2B(g) ![]() 2C(g)ЁЁІЄH=+QЃЈQ>0ЃЉЃЌЬѕМўБфЛЏЪБЃЌгАЯьЦНКтвЦЖЏЕФЙиЯЕШчЭМЫљЪОЁЃЯТСаЫЕЗЈВЛе§ШЗЕФЪЧЃЈ ЃЉ
2C(g)ЁЁІЄH=+QЃЈQ>0ЃЉЃЌЬѕМўБфЛЏЪБЃЌгАЯьЦНКтвЦЖЏЕФЙиЯЕШчЭМЫљЪОЁЃЯТСаЫЕЗЈВЛе§ШЗЕФЪЧЃЈ ЃЉ
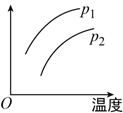
A. p1<p2ЃЌзнзјБъжИAЕФжЪСПЗжЪ§
B. p1>p2ЃЌзнзјБъжИCЕФжЪСПЗжЪ§
C. p1>p2ЃЌзнзјБъжИЛьКЯЦјЬхЕФЦНКтФІЖћжЪСП
D. p1>p2ЃЌзнзјБъжИAЕФзЊЛЏТЪ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЮяжЪдкЫЎжаШмНтадзюКУЕФЪЧ( )
A. CCl4 B. SO2 C. NH3 D. CH4
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПСђЛЏЧтЪЧвЛжжгаГєМІЕАЦјЮЖЕФОчЖОЦјЬх,дкЩњВњЁЂЩњЛюМАПЦбажаОљгаживЊгІгУЁЃ
ЃЈ1ЃЉЙЄвЕЩЯВЩгУИпЮТШШЗжНтH2SЕФЗНЗЈжЦШЁH2,дкФЄЗДгІЦїжаЗжРыГіH2,ЗЂЩњЕФЗДгІЮЊ2H2S(g)![]() 2H2(g)+S2(g)ЁїH
2H2(g)+S2(g)ЁїH
вбжЊЃКЂйH2S(g)![]() H2(8)+S(g)ЁїH1
H2(8)+S(g)ЁїH1
Ђк2S(g)![]() S2(g)ЁїH2
S2(g)ЁїH2
дђЁїH=________(гУКЌЁїH1ЁЂЁїH2ЕФЪНзгБэЪО)ЁЃ
ЃЈ2ЃЉдкШнЛ§2 LЕФКуШнУмБеШнЦїжа,ПижЦВЛЭЌЮТЖШНјааH2SЗжНтЃК2H2S(g)![]() 2H2(g)+S2(g)ЁЃH2SЕФЦ№ЪМЮяжЪЕФСПОљЮЊ1mol,ЪЕбщЙ§ГЬжаВтЕУH2SЕФзЊЛЏТЪШчЭМ1ЫљЪОЁЃЧњЯпaБэЪОH2SЕФЦНКтзЊЛЏТЪгыЮТЖШЕФЙиЯЕ,ЧњЯпbБэЪОВЛЭЌЮТЖШЯТЗДгІОЙ§ЯрЭЌЪБМфЪБH2SЕФзЊЛЏТЪЁЃ
2H2(g)+S2(g)ЁЃH2SЕФЦ№ЪМЮяжЪЕФСПОљЮЊ1mol,ЪЕбщЙ§ГЬжаВтЕУH2SЕФзЊЛЏТЪШчЭМ1ЫљЪОЁЃЧњЯпaБэЪОH2SЕФЦНКтзЊЛЏТЪгыЮТЖШЕФЙиЯЕ,ЧњЯпbБэЪОВЛЭЌЮТЖШЯТЗДгІОЙ§ЯрЭЌЪБМфЪБH2SЕФзЊЛЏТЪЁЃ

ЂйЗДгІ2H2S (g)![]() 2H2(g)+S2(g)ЪЧЗХШШЛЙЪЧЮќШШЃЌХаЖЯВЂЫЕРэгЩ________ЁЃ
2H2(g)+S2(g)ЪЧЗХШШЛЙЪЧЮќШШЃЌХаЖЯВЂЫЕРэгЩ________ЁЃ
ЂкЫцзХH2SЗжНтЮТЖШЕФЩ§Ип,ЧњЯпbЯђЧњЯпaж№НЅППНќ,ЦфдвђЪЧ________ ЁЃ
Ђлдк985ЁцЪБ,ИУЗДгІОЙ§5 sДяЕНЦНКт,дђИУЗДгІЕФЦНКтГЃЪ§ЮЊ________ЁЃдкЭМ2жаЛГі985ЁцЪБ,0ЁЋ6s ЬхЯЕжаS2(g)ХЈЖШЫцЪБМфЕФБфЛЏЧњЯпЁЃ___________________


ЃЈ3ЃЉЙЄвЕЩЯГЃгУNaOHШмвКЮќЪеH2SЗЯЦј,ЮќЪеКѓЫљЕУШмвКНјааЕчНт(зАжУШчЭМ3ЫљЪО),дкбєМЋЧјПЩЩњГЩSx2-,аДГіЩњГЩSx2-РызгЕФЕчМЋЗДгІЪНЃК________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСагаЙиЛЏбЇПЦбЇЕФЫЕЗЈжае§ШЗЕФЪЧЃЈ ЃЉ
A.ЛЏбЇбаОПЛсдьГЩбЯжиЕФЛЗОГЮлШОЃЌзюжеШЫРрЛсЛйУ№дкЛЏбЇЮяжЪжа
B.ЛЏбЇбаОПЕФжївЊФПЕФЪЧШЯЪЖЗжзг
C.ЛЏбЇМвПЩвджЦдьГіздШЛНчжаВЛДцдкЕФЮяжЪ
D.ЖэЙњЛЏбЇМвУХНнСаЗђЬсГіСЫдзгбЇЫЕЃЌЮЊНќДњЛЏбЇЕФЗЂеЙЕьЖЈСЫЛљДЁ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвјЪЧвЛжжЙѓН№ЪєЃЌЙХДњГЃгУгкжЦдьЧЎБвМАзАЪЮЦїУѓЃЌЯжДњдкЕчГиКЭееУїЦїВФЕШСьгђвргаЙуЗКгІгУЁЃЛиД№ЯТСаЮЪЬтЁЃ
ЃЈ1ЃЉОУДцЕФвјжЦЦїУѓБэУцЛсБфКкЃЌЪЇШЅвјАзЩЋЕФЙтдѓЃЌдвђЪЧ________ЁЃ
ЃЈ2ЃЉвбжЊKsp(AgCl)=1.8ЁС10-10ЃЌЯђVmL0.018mol/LЕФAgNO3ШмвКМгVmL0.020mol/LЕФбЮЫсЃЌЛьКЯКѓШмвКжаЕФAg+ЕФХЈЖШЮЊ______mol/LЃЌpHЮЊ________ЁЃ
ЃЈ3ЃЉAgNO3ШмвКЙтеевзЗжНтЃЌЩњГЩAgКЭКьзиЩЋЦјЬхЕШЮяжЪЃЌЦфЙтееЗжНтЕФЛЏбЇЗНГЬЪНЮЊ________ЁЃ
ЃЈ4ЃЉШчЭМЫљЪОдЕчГие§МЋЕФЗДгІЪНЮЊ_________ЁЃ

ВщПДД№АИКЭНтЮі>>
АйЖШжТаХ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com