
| A. | 有7个周期,18个族 | |
| B. | 第IA族元素也称为碱金属元素 | |
| C. | 元素种类最多的族为第IIIB族 | |
| D. | 第七周期若排满,最多可排50种元素 |
分析 A、元素周期表有7横行被称为7个周期;元素周期表有18纵行被称为16个族;
B.IA族包含碱金属与氢元素;
C.元素周期表中第ⅢB族含有镧系和锕系;
D、第六、七周期均最多有32种元素.
解答 解:A、元素周期表有7横行被称为7个周期;元素周期表有18纵行被称为16个族,所以元素周期表有7个周期、16个族,故A错误;
B.IA族包含碱金属与氢元素,除氢之外的其它元素属于碱金属,故B错误;
C.元素周期表中第ⅢB族含有镧系和锕系,则第ⅢB族元素的种类最多,故C正确;
D、第六、七周期均最多有32种元素,不是50种,故D错误;
故选C.
点评 本题考查元素周期表的结构,为高频考点,比较基础,旨在考查学生对基础知识的掌握、有利于培养学生良好的科学素养.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下为气体 | B. | 不能发生氧化反应 | ||
| C. | 不能自身加成形成聚氯乙烯 | D. | 能使溴的CCl4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 LH2O中含有极性键的数目为2NA | |
| B. | 78 g Na2O2中含有的阴离子数为NA | |
| C. | 11 g重水(D218O)中含有的电子数力5NA | |
| D. | 常温常压下,5.6 g铁粉在7.1 g氯气中充分燃烧,转移的电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
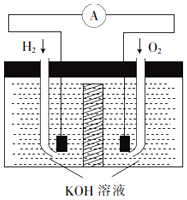 氢氧燃料电池是符合绿色化学理念的新型发电装置.其工作原理如图所示,该电池的电极表面镀了一层细小的铂粉,已知铂吸附气体的能力强,且性质稳定.
氢氧燃料电池是符合绿色化学理念的新型发电装置.其工作原理如图所示,该电池的电极表面镀了一层细小的铂粉,已知铂吸附气体的能力强,且性质稳定.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaH在水中显碱性 | |
| B. | NaH中氢元素的离子的电子层排布与氖原子的电子层排布相同 | |
| C. | 微粒半径H-<Li+ | |
| D. | NaH与H2O反应时,水作还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 离子 | Cu2+ | H+ | Cl- | SO42- |
| c/(mol•L-1) | 0.5 | 2 | 2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
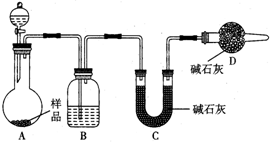 为测定放置已久的小苏打样品中纯碱的质量分数,设计如下实验方案:
为测定放置已久的小苏打样品中纯碱的质量分数,设计如下实验方案:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com