
将Cu、Cu2O和 CuO均匀混合物分成两等份,其中一份用足量的CO还原,测得反应后固体质量减少6.4g,另一份中加入150mL某浓度的硝酸,固体恰好完全溶解,且同时收集到标准状况下NOX气体6.72L,则所用硝酸的物质的量浓度可能为
A.8.0mol·L-1 B. 9.0mol·L-1 C.10.0mol·L-1 D.11.0mol·L-1
CD
【解析】
试题分析:将Cu2O拆分为Cu、CuO,原混合物看做Cu、CuO的混合物,其中一份用足量的CO气还原,反应后固体质量减少6.40g为拆分后Cu、CuO的混合物中O元素的质量,O原子的物质的量为6.4/16=0.4mol,根据Cu元素守恒可知n(CuO)=n(O)=0.4mol;另一份中加入150mL某浓度的硝酸,固体恰好完全溶解,固体恰好完全溶解,溶液中溶质为Cu(NO3)2,且同时收集到标准状况下NOX气体6.72L,,NOX的物质的量为6.72/22.4=0.3mol,若为NO:则根据电子转移守恒可知拆分后Cu、CuO的混合物中2n(Cu)=3n(NO)=3×0.3mol,n(Cu)=0.45mol,由铜元素守恒可知n[Cu(NO3)2]=n(CuO)+n(Cu)=0.4mol+0.45mol=0.85mol,根据氮元素守恒可知n(HNO3)=n(NO)+2n[Cu(NO3)2]=0.3mol+2×0.85mol=2mol,硝酸的浓度为2/0.15=11.3mol/L。若为NO2:则根据电子转移守恒可知拆分后Cu、CuO的混合物中2n(Cu)=n(NO2)=0.3mol,n(Cu)=0.15mol,由铜元素守恒可知n[Cu(NO3)2]=n(CuO)+n(Cu)=0.4mol+0.15mol=0.55mol,根据氮元素守恒可知n(HNO3)=n(NO)+2n[Cu(NO3)2]=0.3mol+2×0.55mol=1.4mol,硝酸的浓度为1.4/0.15=9.3mol/L。故选:A.故硝酸的物质的量浓度可能为10.0mol·L-1 和11.0mol·L-1之间。
考点:本题考查了混合物的计算、守恒计算等。


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
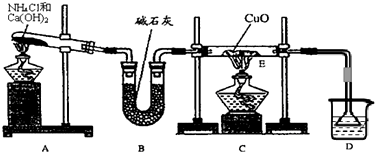
查看答案和解析>>
科目:高中化学 来源: 题型:

| H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com