
| A. | $\frac{56b}{a}$ | B. | $\frac{b}{168a}$ | C. | $\frac{3b}{168a}$ | D. | $\frac{b}{56a}$ |
分析 根据n=$\frac{m}{M}$计算Fe2+的物质的量,1molFeSO4电离得到1molFe3+、1molSO42-,则溶液中n(SO42-)=(Fe2+),再根据c=$\frac{n}{V}$计算SO42-的物质的量浓度,再结合溶液体积与浓度成反比计算出稀释后溶液中硫酸根离子的浓度.
解答 解:bgFe2+的物质的量为:$\frac{bg}{56g/mol}$=$\frac{b}{56}$mol,
1molFeSO4电离得到1molFe3+、1molSO42-,
则aL原溶液中含有硫酸根离子的物质的量为$\frac{b}{56}$mol,
原溶液中SO42-的物质的量浓度为:$\frac{\frac{b}{56}mol}{aL}$=$\frac{b}{56a}$mol/L,
将aL上述溶液稀释为原来3倍,则原溶液中的SO42-的物质的量浓度变为原先的$\frac{1}{3}$,
所以稀释后溶液中SO42-的物质的量浓度为:$\frac{b}{56a}$mol/L×$\frac{1}{3}$=$\frac{b}{168a}$mol/L,
故选B.
点评 本题考查了物质的量浓度的计算,题目难度中等,明确吸收过程中溶质的物质的量不变为解答关键,注意熟练掌握物质的量浓度的概念及计算方法,试题培养了学生灵活应用基础知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 凡是铵盐均能与苛性钠共热产生氨气 | |
| B. | 向铜粉中加人稀硫酸,铜粉不溶解;再加人Cu(NO3)2固体,铜粉溶解 | |
| C. | 普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高 | |
| D. | 将二氧化硫通人溴水,溴水褪色后加热不能恢复原色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
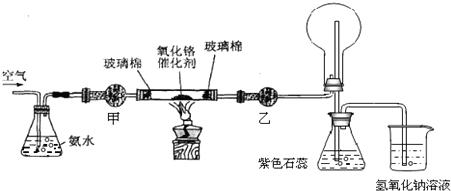
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2Se的沸点高于H2S,可推测PH3的沸点高于NH3 | |
| B. | 17g羟基(-OH)所含有的电子数是9NA | |
| C. | σ键是镜面对称,而π键是轴对称 | |
| D. | 标准状况下,11.2 L三氯甲烷所含分子数为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 蒸馏 | B. | 分液 | C. | 过滤 | D. | 溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钾 空气 苛性钾 | |
| B. | 烧碱 氢氧化铁胶体 胆矾(CuSO4•5H2O) | |
| C. | 纯碱 硫酸铜溶液 氧化铜 | |
| D. | 熟石灰 绿矾(FeSO4•7H2O) 石灰石 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氧化亚铁和稀硫酸的反应 FeO+2H+═Fe3++H2O | |
| B. | 用食醋清洗水垢(主要成分是碳酸钙)2CH3COOH+CO32-═2CH3COO-+CO2↑+H2O | |
| C. | 稀硝酸可溶解新制的氢氧化铜悬浊液Cu(OH)2+2H+═Cu2++2H2O | |
| D. | 盐酸和氨水反应 H++NH3•H2O═H2O+NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com