
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 铅蓄电池放电时,正极的质量会变小 | |
| B. | 对于某耗氧燃料电池.无论负极通入何种燃料,若转移电子总数相等,则正极消耗等质量的氧气 | |
| C. | 可以通过适当的电解装置实现反应2Ag+2H+=2Ag++H2↑ | |
| D. | 电解精炼铜,阳极为粗铜,电镀铜,阳极为纯铜 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高二上9月调研化学试卷(解析版) 题型:选择题
可逆反应:2NO2(g) 2NO(g)+O2(g),在体积固定的密闭容器中,达到平衡状态的标志是( )
2NO(g)+O2(g),在体积固定的密闭容器中,达到平衡状态的标志是( )
①单位时间内生成n mol O2 的同时生成2n mol NO2
的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO 2、NO、O2表示的反应速率的比为2∶2∶1的状态
2、NO、O2表示的反应速率的比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
A.①④⑥⑦ B.②③⑤⑦ C. ①③④⑤ D.全部
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省高一上第一次月考化学卷(解析版) 题型:选择题
与3.2 g SO2 所含的氧原子数相等的NO2的质量为
A.2.3 g B.3.2 g C.4.6 g D.6.4 g
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是我校实验室化学试剂浓硫酸标签上的部分内容.现需要480mL 1mol•L-1的稀硫酸.用该浓硫酸和蒸馏水配制,可供选用的仪器有:①胶头滴管;②玻璃棒;③烧杯;④量筒.
如图是我校实验室化学试剂浓硫酸标签上的部分内容.现需要480mL 1mol•L-1的稀硫酸.用该浓硫酸和蒸馏水配制,可供选用的仪器有:①胶头滴管;②玻璃棒;③烧杯;④量筒.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ①④ | D. | ② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
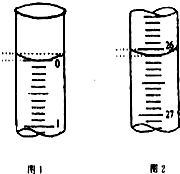 某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择甲基橙作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择甲基橙作指示剂.请填写下列空白:| 滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol•L-1盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com