
ЁОЬтФПЁПЃЈ1ЃЉЬЧРрЁЂгЭжЌЁЂЕААзжЪКЭЮЌЩњЫиЖМЪЧШЫРрЕФЛљБОгЊбјЮяжЪЃЌЯТБэЮЊФГЦЗХЦбрТѓЦЌБъЧЉжаЕФвЛВПЗжЁЃ

ИУбрТѓЦЌЕФгЊбјГЩЗжжаЃЌФмгыЫЎЗДгІЩњГЩАБЛљЫсЕФгЊбјЮяжЪЪЧ_________ЃЌУППЫгЊбјЮяжЪбѕЛЏЪБЗХГіФмСПзюЖрЕФЪЧ_________ЃЌвЛАугЊбјЁЂНЁПЕРрдгжОжаЬсЕНЕФЁАЬМЫЎЛЏКЯЮяЁБЪЧжИ_________ЃЌШЫЬхБиашЕФЮЂСПдЊЫиЪЧ_________ЃЛ
ЃЈ2ЃЉЮЌЩњЫиCвзШмгкЫЎЃЌЯђЦфЫЎШмвКжаЕЮШызЯЩЋЪЏШяЪдвКЃЌЪЏШяБфКьЩЋЃЌМгШШИУШмвКжСЗаЬкЃЌКьЩЋЯћЪЇЃЌвђДЫЃЌХыЕїИЛКЌЮЌЩњЫиCЕФЪГЮяЪБЃЌгІИУзЂвт_________ЃЛдкМюадЬѕМўЯТЃЌЮЌЩњЫиCвзБЛПеЦјбѕЛЏЃЌЩежѓЪБзюКУМгвЛЕу_________ЃЛ
ЃЈ3ЃЉЮвУЧДЉЕФвТЗўЭЈГЃЪЧгЩЯЫЮЌжЏГЩЕФЃЌГЃМћЕФЯЫЮЌгаУоЛЈЁЂбђУЋЁЂЕгТкЕШЃЎгУзЦЩеЗЈПЩГѕВНМјБ№Ш§жжЯЫЮЌЃЌИјШ§жжЯЫЮЌБрКХКѓЃЌЗжБ№зЦЩеВњЩњЕФЦјЮЖШчЯТЃК

дђбђУЋЕФБрКХЮЊ_________ЃЌУоЛЈЕФБрКХЮЊ_________ЃЌЕгТкЕФБрКХЮЊ_________ЁЃ
ЁОД№АИЁПЕААзжЪ гЭжЌ ЬЧРр аП ВЛвЊИпЮТМгШШ ЪГДз Ђл Ђк Ђй
ЁОНтЮіЁП
ЃЈ1ЃЉЕААзжЪФмЗЂЩњЫЎНтЩњГЩАБЛљЫсЁЃ1ПЫгЭжЌдкЬхФкбѕЛЏЗХГіЕФШШСПЮЊ39.3ЧЇНЙЃЌдЖИпгкЬЧРрКЭЕААзжЪЁЃЬЧРргжГЦзїЬМЫЎЛЏКЯЮяЃЌЙЪД№АИЮЊЃКЕААзжЪЃЌгЭжЌЃЌЬЧРрЃЛ
ЃЈ2ЃЉИЦЁЂУОЁЂФЦЖМЪЧГЃСПдЊЫиЃЌаПЪЧЮЂСПдЊЫиЁЃЮЌЩњЫиCЕФЫЎШмвКжаЕЮШызЯЩЋЪЏШяЪдвКБфКьЃЌЫЕУїЮЌЩњЫиCЕФЫЎШмвКЪЧЫсадЕФЃЌМгШШжСЗаЬкЃЌКьЩЋЯћЪЇЃЌЫЕУїЮЌЩњЫиCЪмШШШнвзБЛбѕЛЏЃЌЫљвддкХыЕїКЌЮЌЩњЫиCЕФЪГЮяЪБЃЌВЛвЊИпЮТМгШШЁЃМюадЬѕМўЯТЃЌЮЌЩњЫиCИќвзБЛПеЦјбѕЛЏЃЌЫљвддкЩежѓЕФЪБКђМгвЛЕуЖљЪГДзжаКЭЁЃЙЪД№АИЮЊЃКаПЃЌВЛвЊИпЮТМгШШЃЌЪГДзЃЛ
ЃЈ3ЃЉбђУЋКЭг№УЋЖМЪЧЕААзжЪЃЌзЦЩеЕФЪБКђЦјЮЖЪЧЯрЭЌЕФЁЃУоЛЈКЭжНеХЕФжївЊГЩЗжЖМЪЧЯЫЮЌЫиЃЌзЦЩеЪБЦјЮЖЯрЭЌЁЃЕгТкЪЧКЯГЩЯЫЮЌЃЌзЦЩеЪБЛсгаЬиЪтЦјЮЖЁЃЙЪД№АИЮЊЃКЂлЃЌЂкЃЌЂйЁЃ


 дФЖСПьГЕЯЕСаД№АИ
дФЖСПьГЕЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯжДњЙЄвЕЕФЗЂеЙЕМжТCO2ЕФДѓСПХХЗХЃЌЖдЛЗОГдьГЩЕФгАЯьШевцбЯжиЃЌЭЈЙ§ИїЙњПЦММЙЄзїепЕФХЌСІЃЌвбОПЊЗЂГіаэЖрНЋCO2ЛиЪеРћгУЕФММЪѕЃЌЦфжаДпЛЏзЊЛЏЗЈзюОпгІгУМлжЕЁЃЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉдкДпЛЏзЊЛЏЗЈЛиЪеРћгУCO2ЕФЙ§ГЬжаЃЌПЩФмЩцМАвдЯТЛЏбЇЗДгІЃК
ЂйCO2(g)+2H2O(1)![]() CH3OH(1)+
CH3OH(1)+![]() O2(g) ЁїH=+727kJЁЄmol-1 ЁїG=+703kJЁЄmol-1
O2(g) ЁїH=+727kJЁЄmol-1 ЁїG=+703kJЁЄmol-1
ЂкCO2(g)+2H2O(1)![]() CH4(g)+2O2(g) ЁїH=+890kJЁЄmol-1 ЁїG=+818kJЁЄmol-1
CH4(g)+2O2(g) ЁїH=+890kJЁЄmol-1 ЁїG=+818kJЁЄmol-1
ЂлCO2(g)+3H2(g)![]() CH3OH(1)+H2O(1) ЁїH=-131kJЁЄmol-1 ЁїG=-9.35kJЁЄmol-1
CH3OH(1)+H2O(1) ЁїH=-131kJЁЄmol-1 ЁїG=-9.35kJЁЄmol-1
ЂмCO2(g)+4H2(g)![]() CH4(g)+2H2O(1) ЁїH=-253kJЁЄmol-1 ЁїG=-130kJЁЄmol-1
CH4(g)+2H2O(1) ЁїH=-253kJЁЄmol-1 ЁїG=-130kJЁЄmol-1
ДгЛЏбЇЦНКтЕФНЧЖШРДПДЃЌЩЯЪіЛЏбЇЗДгІжаЗДгІНјааГЬЖШзюаЁЕФЪЧ____ЃЌЗДгІНјааГЬЖШзюДѓЕФЪЧ_____ЁЃ
ЃЈ2ЃЉЗДгІCO2(g)+4H2(g)=CH4(g) +2H2O(g)ГЦЮЊSabatierЗДгІЃЌПЩгУгкдиШЫКНПеКНЬьЙЄвЕЁЃЮвЙњЛЏбЇЙЄзїепЖдИУЗДгІЕФДпЛЏМСМАДпЛЏаЇТЪНјааСЫЩюШыЕФбаОПЁЃ
ЂйдкдиШЫКНЬьЦїжаРћгУSabatierЗДгІЪЕЯжЛиЪеCO2дйЩњO2ЃЌЦфЗДгІЙ§ГЬШчЭМЫљЪОЃЌетжжЗНЗЈдйЩњO2ЕФзюДѓШБЕуЪЧашвЊВЛЖЯВЙГф_________ЃЈЬюЛЏбЇЪНЃЉЁЃ

Ђкдк1.5 MPaЃЌЦјЬхСїЫйЮЊ20 mLЁЄmin-lЪБбаОПЮТЖШЖдДпЛЏМСДпЛЏадФмЕФгАЯьЃЌЕУЕНCO2ЕФзЊЛЏТЪ(%)ШчЯТЃК
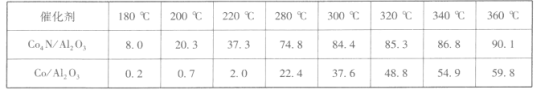
ЗжЮіЩЯБэЪ§ОнПЩжЊЃК_____ЃЈЬюЛЏбЇЪНЃЉЕФДпЛЏадФмИќКУЁЃ
ЂлЕїећЦјЬхСїЫйЃЌбаОПЦфЖдФГвЛДпЛЏМСДпЛЏаЇТЪЕФгАЯьЃЌЕУЕНCO2ЕФзЊЛЏТЪ(%)ШчЯТЃК
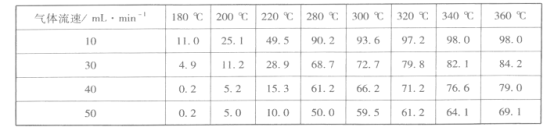
ЗжЮіЩЯБэЪ§ОнПЩжЊЃКЯрЭЌЮТЖШЪБЃЌЫцзХЦјЬхСїЫйдіМгЃЌCO2ЕФзЊЛЏТЪ____ЃЈЬюЁАдіДѓЁБЛђЁАМѕаЁЁБЃЉЃЌЦфПЩФмЕФдвђЪЧ_________________________________ЁЃ
ЂмдкЩЯЪіЪЕбщЬѕМўжаЃЌSabatierЗДгІзюПЩФмДяЕНЛЏбЇЦНКтзДЬЌЕФЮТЖШЪЧ____ЃЌвбжЊГѕЪМЗДгІЦјЬхжаV(H2):V(CO2) =4:lЃЌЙРЫуИУЮТЖШЯТЕФЦНКтГЃЪ§ЮЊ ___________ЃЈСаГіМЦЫуБэДяЪНЃЉЁЃ
ЃЈ3ЃЉЭЈЙ§ИФБфДпЛЏМСПЩвдИФБфCO2гыH2ЗДгІДпЛЏзЊЛЏЕФВњЮяЃЌШчРћгУCoЃЏCзїЮЊДпЛЏМСЃЌЗДгІКѓПЩвдЕУЕНКЌгаЩйСПМзЫсЕФМзДМЁЃЮЊСЫбаОПДпЛЏМСЕФЮШЖЈадЃЌНЋCo/CДпЛЏМСбЛЗЪЙгУЃЌЯрЭЌЬѕМўЯТЃЌЫцзХбЛЗЪЙгУДЮЪ§ЕФдіМгЃЌМзДМЕФВњСПШчЭМЫљЪОЃЌЪдЭЦВтМзДМВњСПБфЛЏЕФдвђ_________________________________ЁЃЃЈвбжЊCoЕФаджЪгыFeЯрЫЦЃЉ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвЛЖЈСПЕФЛьКЯЦјЬхЃЌдкУмБеШнЦїжаЗЂЩњШчЯТЗДгІЃКxAЃЈgЃЉЃЋyBЃЈgЃЉ![]() zCЃЈgЃЉЃЌДяЕНЦНКтКѓВтЕУAЦјЬхЕФХЈЖШЮЊ0.5 molЁЄL-1ЃЌЕБКуЮТЯТНЋУмБеШнЦїЕФШнЛ§РЉДѓЕНСНБЖдйДяЕНЦНКтКѓЃЌВтЕУAХЈЖШЮЊ0.3 molЁЄL-1ЃЌдђЯТСаа№Ъіе§ШЗЕФЪЧ
zCЃЈgЃЉЃЌДяЕНЦНКтКѓВтЕУAЦјЬхЕФХЈЖШЮЊ0.5 molЁЄL-1ЃЌЕБКуЮТЯТНЋУмБеШнЦїЕФШнЛ§РЉДѓЕНСНБЖдйДяЕНЦНКтКѓЃЌВтЕУAХЈЖШЮЊ0.3 molЁЄL-1ЃЌдђЯТСаа№Ъіе§ШЗЕФЪЧ
A. ЦНКтЯђе§ЗДгІЗНЯђвЦЖЏ B. x+yЃМz
C. C ЕФЬхЛ§ЗжЪ§НЕЕЭ D. BЕФзЊЛЏТЪЬсИп
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЃЈ1ЃЉаДГіЯТСаЮяжЪШмгкЫЎЕФЕчРыЗНГЬЪНЃК
HNO3ЃК________________________________________________________ЃЛ
NH3H2OЃК_____________________________________________________ЃЛ
ЃЈ2ЃЉАДвЊЧѓаДГіЗНГЬЪНЁЃ
ЂйЬњКЭЯЁСђЫсЃЈаДГіРызгЗНГЬЪНЃЉ_________________________________________ЃЛ
ЂкЧтбѕЛЏБЕШмвККЭЯЁСђЫсЃЈаДГіРызгЗНГЬЪНЃЉ_______________________________ЃЛ
ЂлбѕЛЏЭКЭЯЁбЮЫсЃЈаДГіРызгЗНГЬЪНЃЉ_____________________________________ЃЛ
ЂмжЦБИЧтбѕЛЏЬњНКЬхЃЈаДГіЖдгІЕФЛЏбЇЗНГЬЪНЃЉ_____________________________ЃЛ
ЂнCO32-+2H+=CO2Ёќ+H2OЃЈаДГіЖдгІЕФЛЏбЇЗНГЬЪНЃЉ_____________________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП(1)НЋЕШОЖдВЧђдкЖўЮЌПеМфРяНјааХХСаЃЌПЩаЮГЩУмжУВуКЭЗЧУмжУВуЃЌдкЭМ1ЫљЪОЕФАыОЖЯрЕШЕФдВЧђЕФХХСажаЃЌAЪєгк________ВуЃЌХфЮЛЪ§ЪЧ________ЃЛBЪєгк________ВуЃЌХфЮЛЪ§ЪЧ________ЁЃ
(2)НЋЗЧУмжУВувЛВувЛВуЕидкШ§ЮЌПеМфРяЖбЛ§ЃЌЕУЕНШчЭМ2ЫљЪОЕФвЛжжН№ЪєОЇЬхЕФОЇАћЃЌЫќБЛГЦЮЊМђЕЅСЂЗНЖбЛ§ЃЌдкетжжОЇЬхжаЃЌН№ЪєдзгЕФХфЮЛЪ§ЪЧ________ЃЌЦНОљУПИіОЇАћЫљеМгаЕФдзгЪ§ФПЪЧ________ЁЃ

(3)газЪСЯБэУїЃЌжЛгаюЧЕФОЇЬхжаЕФдзгОпгаШчЭМ2ЫљЪОЕФЖбЛ§ЗНЪНЃЌюЧЮЛгкдЊЫижмЦкБэЕФЕк________жмЦкЕк__________зхЃЌдЊЫиЗћКХЪЧ________ЃЌзюЭтЕчзгВуЕФЕчзгХХВМЪНЪЧ________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГгаЛњЛЏКЯЮяЕФНсЙЙЪНШчЭМЃЌЦфжаWЁЂXЁЂYЁЂZЮЊдзгађЪ§вРДЮдіДѓЕФЖЬжмЦкдЊЫиЃЌYдзгКЫЭтзюЭтВуЕчзгЪ§ЪЧЦфЕчзгВуЪ§ЕФ3БЖЃЌXгыZЮЛгкВЛЭЌЕФжмЦкЃЌЯТСагаЙиЫЕЗЈе§ШЗЕФЪЧ

A.ЦјЬЌЧтЛЏЮяЕФШШЮШЖЈадЃКX>Y
B.XЁЂWЁЂZШ§епаЮГЩЕФЛЏКЯЮяЖМЪЧвКЬх
C.W2Y2жаМШКЌМЋадМќгжКЌЗЧМЋадМќ
D.ZдЊЫиаЮГЩЕФКЌбѕЫсШЋВПЪЧЧПЫс
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЪЕбщЪвгУNaOHШмвКВЖЛёCO2ЁЃЯђХЈЖШЯрЕШЁЂЬхЛ§ОљЮЊ50mLЕФAЁЂBСНЗнNaOHШмвКжаЃЌЗжБ№ЭЈШывЛЖЈСПЕФCO2КѓЃЌдйЯЁЪЭЕН100mLЁЃдкЯЁЪЭКѓЕФШмвКжаж№ЕЮМгШы0.1mol/LЕФбЮЫсЃЌВњЩњCO2ЕФЬхЛ§ЃЈБъзМзДПіЃЉгыЫљМгбЮЫсЕФЬхЛ§ЙиЯЕШчЭМЫљЪОЃЎ
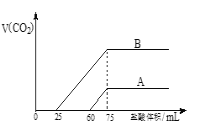
ЃЈ1ЃЉЧњЯпBБэУїдШмвКжаЭЈШыCO2КѓЃЌЫљЕУШмвКжаЕФШмжЪЮЊЃЈаДЛЏбЇЪНЃЉ_____________ЃЌЦфЮяжЪЕФСПжЎБШЮЊ__________________ЁЃЕБКФбЮЫс0<v(HCl)<25 mLЪБЗЂЩњЕФРызгЗДгІЮЊЃК____________ЁЃ
ЃЈ2ЃЉЧњЯпAБэУїЃЌзюГѕЭЈШыЕФCO2дкБъзМзДПіЯТЕФЬхЛ§ЮЊ_________mLЁЃ
ЃЈ3ЃЉЭЈЙ§МЦЫуЧѓГідNaOHШмвКЕФЮяжЪЕФСПХЈЖШ______________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСагаЙиЫЕЗЈе§ШЗЕФЪЧ
A. 298 KЪБЃЌ2H2S(g)ЃЋSO2(g)===3S(s)ЃЋ2H2O(l)ФмздЗЂНјааЃЌдђЦфІЄHЃО0
B. АБЫЎЯЁЪЭКѓЃЌШмвКжаc(NH4ЃЋ)/c(NH3ЁЄH2O)ЕФжЕМѕаЁ
C. ЕчНтОЋСЖЭЙ§ГЬжаЃЌбєМЋжЪСПЕФМѕЩйгывѕМЋжЪСПЕФдіМгвЛЖЈЯрЕШ
D. 25ЁцЪБKa(HClO)ЃН3.0ЁС108ЃЌKa(HCN)ЃН4.9ЁС1010ЃЌШєИУЮТЖШЯТNaClOШмвКгыNaCNШмвКЕФpHЯрЭЌЃЌдђc(NaClO)ЃОc(NaCN)
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЧтФмЪЧвЛжжЙЋШЯЕФИпШШжЕЧхНрФмдДЃЌФПЧАЪРНчИїЙње§жТСІгкНЋИпЮлШОИпХХЗХЕФЬМФмдДЙ§ЖЩГЩЧхНрИпаЇЕЭХХЗХЕФЧтФмдДЁЃЧтФмПЊЗЂАќРЈвдЯТШ§ИіЛЗНкЃК
вЛЁЂЧтШМСЯЕФжЦБИ
(1)ЮвЙњЧтЦјЕФжївЊРДдДЪЧНЙТЏЦјжЦЧтЃЌЫљжЦЕУЕФЧтЦјКЌгаНЯЖрЕФCOКЭH2SЃЌжаЮТИЩЗЈЭбСђЪЧгУбѕЛЏЬњНЋСђдЊЫизЊЛЏЮЊСђЛЏЬњЁЃИЩЗЈЭбСђЕФЗДгІЗНГЬЪНЮЊ________ЁЃ
(2)ЮвЙњПЦбаШЫдБгУФОаМЫЎеєЦћЦјЛЏжЦШЁЧтШМСЯЃЌдквЛЖЈЬѕМўЯТЃЌЗДгІЦїжаДцдкШчЯТЗДгІЃК
i.CO2 (g) +C(s)=2CO (g) ЁїH1
ii.C(s) + H2O(g)=CO ( g) + H2 (g) ЁїH2
iii.C(s) + 2H2 (g)=CH4( g) ЁїH3
iv.CO(g) + H2O(g)=CO2 ( g) + H2 (g) ЁїH4
v. CH4(g)+ 2 H2O(g)= CO2 ( g) + 4H2 (g) ЁїH5
ЂйЁїH5=_________________ ЁЃ
ЂкбаОПжа CaO ЕФЬэМгСПАДееCaO жаЫљКЌЕФCa КЭЫЩФОаМЫљКЌЬМЕФЮяжЪЕФСПБШШЗЖЈЃЌдк750ЁцЃЌПижЦЫЎеєЦјСїСПЮЊ 0.lg/(ming)ЯТЃЌЬНОПДпЛЏМСМгШыСПЖдВњЦјзщЗжКЭЦјЛЏадФмЕФгАЯьЃЌНсЙћШчБэЫљЪОЃК
n(Ca)/n(C) | ЦјЬхЬхЛ§ЗжЪ§ | ЬМзЊЛЏТЪ/% | |||
H2 | CO | CO2 | CH4 | ||
0 | 45.58 | 22.70 | 22.37 | 7.54 | 61.22 |
0.5 | 52.95 | 21.74 | 19.11 | 5.14 | 56.59 |
1.0 | 58.62 | 22.37 | 12.60 | 5.31 | 61.42 |
гЩБэжаЪ§ОнЃЌn(Ca) / n(C) =___ЪБзюЮЊКЯРэЁЃ n(Ca) / n(C) гЩ0ЕН0.5ЪБЃЌH2ЕФЬхЛ§ЗжЪ§ЯджјдіМгЕФдвђ_____ЁЃЬхЯЕЕФЦјЛЏЮТЖШВЛНіЖдФОаМЕФШШНтЦјЛЏЗДгІгагАЯь ЃЌЖјЧвЖд CaO ЮќЪе CO2 ЕФФмСІвдМА CaCO3ЕФЗжНтЗДгІвВгаКмДѓгАЯьЁЃЪЕбщЙ§ГЬжаЃЌПижЦ n(Ca) / n(C) ЮЊ 1.0ЃЌЫЎеєЦјСїСПЮЊ0.1 g/(min g)ЃЌ НЋЦјЛЏЗДгІЮТЖШДг700ЁцЩ§ЕН850ЁцЃЌЦјЛЏЮТЖШЖдВњЧтТЪЁЂВњЦјТЪЕФгАЯьШчБэЃК
ЮТЖШ/Ёц | ЦјЬхЬхЛ§ЗжЪ§ | ЬМзЊЛЏТЪ/% | ||
H2 | CO | CO2 | ||
700 | 51.78 | 20.75 | 19.89 | 54.37 |
750 | 58.62 | 22.37 | 12.60 | 61.42 |
800 | 55.63 | 26.05 | 12.71 | 73.43 |
850 | 54.16 | 26.94 | 13.82 | 83.34 |
ЂлДгВњЧтТЪЕФНЧЖШПМТЧЃЌзюМбВйзїЮТЖШЪЧ________________ЁЃ
ЂмЫцзХЗДгІЕФНјааЃЌЗЂЯж CaO ЕФЮќЪеФмСІж№НЅНЕЕЭЃЌдвђЪЧ___________ЁЃ
ЖўЁЂЧтШМСЯЕФДцДЂ
(3)НЋЧтЦјДЂДцгквКЬхШМСЯжаЃЌПЩвдНтОіЧтЦјЕФАВШЋИпаЇДцДЂКЭдЫЪфЮЪЬтЁЃгЩгкМзДМОпгаЕЅЮЛЬхЛ§ДЂЧтСПИпЁЂЛюЛЏЮТЖШЕЭЕШгХЕуЃЌЪЧРэЯыЕФвКЬхДЂЧтЦНЬЈЗжзгЁЃЮвЙњбЇепЙЙНЈвЛжжЫЋЙІФмНсЙЙЕФДпЛЏМСЃЌЗДгІЙ§ГЬжаЃЌдкДпЛЏМСЕФБэУцЭЌЪБЛюЛЏЫЎКЭМзДМЁЃШчЭМЪЧМзДМЭбЧтзЊЛЏЕФЗДгІРњГЬ( TS БэЪОЙ§ЖЩЬЌЃЉЁЃ
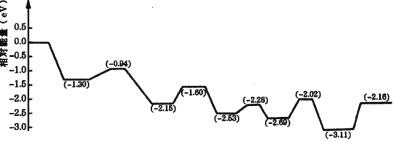
ИљОнЭМЯёХаЖЯМзДМЭбЧтЗДгІжаЖЯСбЕФЛЏбЇМќЪЧ______ЃЌИУЗДгІЕФЁїH___0( ЬюЁАДѓгкЁБЁЂЁАЕШгкЁБЛђЁАаЁгкЁБ)
Ш§ЁЂЧтШМСЯЕФгІгУЁЃвЛжжЧтФмЕчГиЕФдРэШчЭМЃК
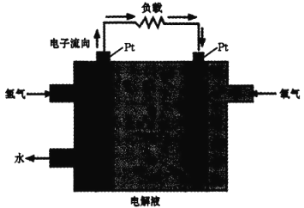
(4)е§МЋЕФЕчМЋЗДгІЪНЮЊ________ЁЃдк Pt ЕчМЋБэУцОЕвЛВуЯИаЁЕФЧІЗлЃЌдвђЪЧ______ЁЃ
ВщПДД№АИКЭНтЮі>>
АйЖШжТаХ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com