
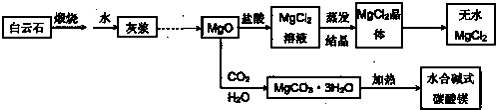
| ||
| 80(m+n) |
| 1.60 |
| 44m |
| 1.32 |
| 18(n+x) |
| 0.72 |


 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
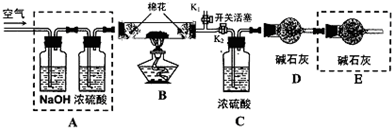
 据报道双氧水接触银能剧烈反应,为消除用硝酸清洗试管内壁上的银时产生的有毒气体污染环境,体现“绿色化学”的理念,某学校活动小组利用该反应清洗试管内壁上的银,并进一步研究反应的机理.他们查阅资料(资料信息:硝酸氧化性比过氧化氢强,能氧化过氧化氢;碘化银为黄色固体;稀硝酸与银单质反应条件为加热),设计并完成了以下实验.
据报道双氧水接触银能剧烈反应,为消除用硝酸清洗试管内壁上的银时产生的有毒气体污染环境,体现“绿色化学”的理念,某学校活动小组利用该反应清洗试管内壁上的银,并进一步研究反应的机理.他们查阅资料(资料信息:硝酸氧化性比过氧化氢强,能氧化过氧化氢;碘化银为黄色固体;稀硝酸与银单质反应条件为加热),设计并完成了以下实验.查看答案和解析>>
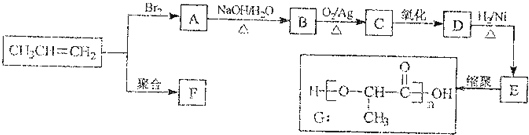
科目:高中化学 来源: 题型:
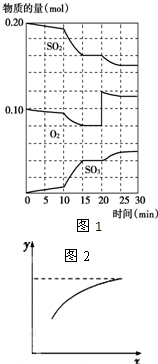 硫酸生产中,接触室内的反应为:
硫酸生产中,接触室内的反应为:
| ||
| △ |
| X | y | |
| A | 再加入SO2 | O2的转化率 |
| B | 再加入SO3 | SO2的体积分数 |
| C | 压强 | 混合气体的物质的量 |
| D | 温度 | 混合气体的平均摩尔质量 |
| 容器 | 甲 | 乙 | 丙 | 丁 |
| 起始投入量 | 2mol SO2+ 1mol O2 | 1mol SO2+ 0.5mol O2 | 2mol SO3 | 2mol SO2+ 2mol O2 |
| 反应放出或 吸收的热量(kJ) | a | b | c | d |
| 平衡时c(SO3)(mol/L) | e | f | g | h |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 编号 | T/K | 大理石 规格 | C(HNO3)/ mol?L-1 | 实验目的 |
| ① | 25℃ | 粗颗粒 | 2.00 | (Ⅰ) 实验①和②探究HNO3浓度对该反应速率的影响;则T1为: (Ⅱ)实验①和 (Ⅲ)实验①和 |
| ② | T1 | 粗颗粒 | 1.00 | |
| ③ | 35℃ | 粗颗粒 | 2.00 | |
| ④ | 25℃ | 细颗粒 | 2.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| pH值 | 6.5-8.5 |
| Ca2+、Mg2+总浓度 | <0.045mol/L |
| 细菌总数 | <100个?mL-1 |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com