
【题目】一种由10%的金和90%的铂制成的合金材料耐磨性比高强度钢高100倍,是迄今最强的合金,可用于制造新型发电系统和发电机。关于该合金材料说法正确的是
A.属于金属材料B.属于无机非金属材料
C.属于硅酸盐材料D.属于合成高分子材料
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 某物质在熔融态下能导电,则该物质中一定含有离子键
B. ![]() 中既有离子键又有共价键,所以
中既有离子键又有共价键,所以![]() 属于离子化合物
属于离子化合物
C. ![]() 和
和![]() 两种分子中,每个原子的最外层都具有8电子稳定结构
两种分子中,每个原子的最外层都具有8电子稳定结构
D. 二氧化硅和干冰都是共价化合物,其溶于水的过程中均只需克服分子间作用力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KIO3是一种重要的无机化合物,可作为食盐中的补碘剂。回答下列问题:
(1)KIO3的化学名称是_________________。
(2)利用“KClO3氧化法”制备KIO3工艺流程如下图所示:
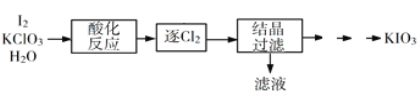
“酸化反应”所得产物有KH(IO3)2、Cl2和KCl。“逐Cl2”采用的方法是______________________。
“滤液”中的溶质主要是__________________。
(3)KIO3也可采用“电解法”制备,装置如图所示。
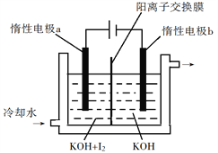
①写出电解时阴极的电极反应式________________________________。
②电解过程中通过阳离子交换膜的离子主要为_______________。
③与“电解法”相比,“KClO3氧化法”的主要不足之处有___________________________________________(写出一点)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以二氧化锰为原料制取高锰酸钾晶体的实验流程如下,下列有关说法正确的是
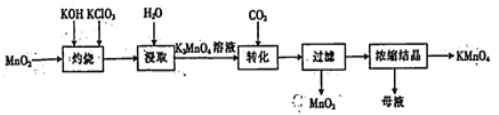
A. “灼烧”时,可在瓷坩埚中进行
B. “浸取”时,可用无水乙醇代替水
C. “转化”反应中,生成的KMnO4与MnO2的物质的量之比为1:2
D. “浓缩结晶”后的母液中仍可能含有KMnO4和K2CO3两种溶质
查看答案和解析>>
科目:高中化学 来源: 题型:
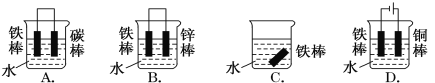
【题目】钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢铁占世界钢铁年产量的四分之一。请回答钢铁在腐蚀、防护过程中的有关问题。
(1)下列哪个装置可防止铁棒被腐蚀________________。
(2)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如图。请回答:
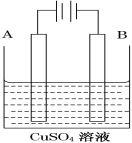
①A电极对应的金属是________(写元素名称),
B电极的电极反应式是___________________________________。
②若电镀前A、B两金属片质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12 g,则电镀时电路中通过的电子为________mol。
③镀层破损后,不易被腐蚀的是___________(填A或B)。
A.镀铜铁 B.镀锌铁 C. 镀锡铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表短周期中六种元素的原子序数与主要化合价的关系如图:
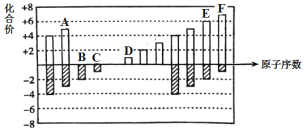
(1)元素F在周期表中的位置是 ______。
(2)元素C、D、E原子半径由大到小的顺序是 ______(填元素符号)。
(3)A、B、C的单质与氢气反应的剧烈程度由强到弱的顺序_____(用单质的化学式表示)。
(4)应用元素周期律和元素周期表的知识,写出D和E所形成的化合物的化学式______、__(写2种)。
(5)根据氯、溴、碘单质间的置换反应,判断F的单质和E的最简单氢化物之间能否发生反应 _____(填“能”或“不能”), 若能则写出反应的化学方程式 ______。
(6)一定温度下,在体积恒定的密闭容器中发生反应:2AB(g)+B2(g) ![]() 2AB2(g)。可以作为达到平衡状态的标志是 ______。
2AB2(g)。可以作为达到平衡状态的标志是 ______。
A. 单位时间内生成nmolB2的同时生成2nmolAB B. 2 ν正(B2)=ν逆(AB2)
C. 混合气体的颜色不再改变(AB2为有色气体) D. 混合气体的密度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 新制饱和氯水中:A13+、Cu2+、SO42-、Br-
B. 甲基橙变红的溶液:Mg2+、Fe2+、NO3-、SCN-
C.  的溶液中:Na+、K+、Cl-、AlO2-
的溶液中:Na+、K+、Cl-、AlO2-
D. 水电离的c(H+)=1×10-13mol/L的溶液中:Ca2+、Ba2+、Cl-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:反应①Fe(s)+CO2(g)FeO(s)+CO(g);△H=Q1,平衡常数为K1,反应②Fe(s)+H2O(g)FeO(s)+H2(g);△H=Q2,平衡常数为K2,
在不同温度下,K1、K2的值如下:
T(K) | K1 | K2 |
700 | 1.47 | 2.38 |
900 | 2.15 | 1.67 |
(1)从上表可推断,反应Q1_____0(填“>”或“<”).
(2)现有反应③H2(g)+CO2(g)CO(g)+H2O(g);△H=Q3平衡常数为K3.根据反应①与②推导出K1、K2、K3的关系式K3=_____,Q1、Q2、Q3的关系式Q3=_____,可推断反应③是_____(填“放”或“吸”)热反应.
(3)要使反应③在一定条件下建立的平衡右移,可采取的措施有_____.
A.缩小容器体积 B.扩大容器的体积 C.降低温度
D.升高温度 E.使用合适的催化剂 F.设法减少CO的量
(4)如图甲、乙表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:
图甲中t2时刻改变的条件可能是_____,图乙中t2时刻改变的条件可能是_____.

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com