
分析 0.1mol•L-1一元酸HA溶液中$\frac{c(O{H}^{-})}{c({H}^{+})}$=1×10-10,c(H+).c(OH-)=1×10-14,所以c(H+)=0.01mol/L,
溶液的pH=-lgc(H+);
①HA溶液中c(H+)小于c(HA),所以HA是一元弱酸,HA和NaOH发生中和反应生成NaA和水;pH=2HA溶液浓度大于0.01mol/L,pH=11的NaOH溶液浓度为0.001mol/L,二者等体积混合,酸剩余,酸的电离程度大于酸根离子水解程度导致溶液呈酸性,结合电荷守恒判断离子浓度大小;
②0.2mol•L-1HA溶液与0.1mol•L-1NaOH溶液等体积混合后溶液中溶质为等物质的量浓度的NaA和HA,其物质的量浓度都是0.05mol/L,根据电荷守恒和物料守恒计算.
解答 解:0.1mol•L-1一元酸HA溶液中$\frac{c(O{H}^{-})}{c({H}^{+})}$=1×10-10,c(H+).c(OH-)=1×10-14,所以c(H+)=0.01mol/L,溶液的pH=-lgc(H+)=-lg0.01=2,故答案为:2;
①HA溶液中c(H+)小于c(HA),所以HA是一元弱酸,HA和NaOH发生中和反应生成NaA和水,离子方程式为HA+OH-=A-+H2O;pH=2HA溶液浓度大于0.01mol/L,pH=11的NaOH溶液浓度为0.001mol/L,二者等体积混合,酸剩余,酸的电离程度大于酸根离子水解程度导致溶液呈酸性,结合电荷守恒得 c(A-)>c(Na+),所以溶液中离子浓度大小顺序是 c(A-)>c(Na+)>c(H+)>c(OH-),
故答案为:HA+OH-=A-+H2O;c(A-)>c(Na+)>c(H+)>c(OH-);
②0.2mol•L-1HA溶液与0.1mol•L-1NaOH溶液等体积混合后所得溶液中,由电荷守恒有:c(Na+)+c(H+)=c(A-)+c(OH-),由物料守恒有:2c(Na+)=c(A-)+c(HA),故c(H+)+c(HA)-c(OH-)=c(Na+)=$\frac{1}{2}$×0.1mol/L=0.05mol/L,
故答案为:0.05.
点评 本题考查弱电解质的电离、酸碱混合溶液定性判断、pH计算等知识点,侧重考查学生分析计算能力,明确溶液中溶质及其性质是解本题关键,对于离子浓度大小比较要注意结合电荷守恒和物料守恒分析解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
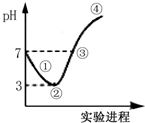 常温下,将Cl2缓缓通入水中至饱和,然后向所得饱和溶液中滴加0.1mol•L-1 NaOH溶液,整个过程中pH的变化如图所示.下列有关叙述正确的是( )
常温下,将Cl2缓缓通入水中至饱和,然后向所得饱和溶液中滴加0.1mol•L-1 NaOH溶液,整个过程中pH的变化如图所示.下列有关叙述正确的是( )| A. | 从反应开始至②点,发生反应的离子方程式为:Cl2+H2O═ClO-+2H++Cl- | |
| B. | ③处表示氯气和NaOH溶液恰好完全反应 | |
| C. | ②点所表示的溶液中所存在的具有氧化性的含氯元素的微粒主要有:Cl2、HClO、ClO- | |
| D. | 从反应开始至②点可用pH试纸测定溶液的pH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m>n | B. | m<n | C. | m=n | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X与Y形成的化合物既能与盐酸反应也能与氢氧化钠反应 | |
| B. | X的原子半径大于Z的原子半径 | |
| C. | X与Z形成的化合物的水溶液中逐滴滴加氨水至过量,先产生白色沉淀后沉淀溶解 | |
| D. | Z的最高价氧化物对应的水化物为强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度可使该反应的逆反应速率降低 | |
| B. | 反应达平衡后,CO的反应速率保持不变 | |
| C. | 使用高效催化剂可有效提高正、逆反应速率 | |
| D. | 单位时间内消耗CO和N2的物质的量之比为2:1时,反应达到平衡 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com