
| Kw |
| c(OH-) |
| 0.1mol/L×0.01L |
| 1L |
| Kw |
| c(OH-) |
| 10-14 |
| 0.01 |


 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA |
| 2 | c | d | |||||
| 3 | a | b | e | f |
| A、e的氢化物比d的氢化物稳定 |
| B、a、b、e三种元素的原子半径:e>b>a |
| C、六种元素中,c元素单质的化学性质最活泼 |
| D、c、e、f的最高价氧化物对应的水化物都是酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,2.24L C6H14中含有的共用电子对数为1.9NA |
| B、同温同压下,原子数均为NA的氢气和氦气具有相同的体积 |
| C、0.50mol的亚硫酸钠中含有的钠离子数为NA |
| D、常温下,7.1gCl2与足量NaOH溶液作用,转移电子的数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,PH=9的碳酸钠溶液中由水电离出的c(OH-)=1×10-9mol?L-1 |
| B、温度相同时,在弱酸溶液和强碱稀溶液中,水的离子积常数Kw相同 |
| C、将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 |
| D、中和等体积pH相同的H2SO4和HCl溶液,消耗NaOH的物质的量为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
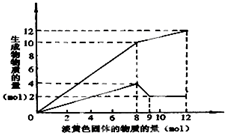 某溶液中可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+中的一种或几种.当加入一种淡黄色固体并加热溶液时,有刺激性气体放出和白色沉淀生成,加入淡黄色固体的物质的量(横坐标)与析出沉淀和产生气体的物质的量(纵坐标)的关系,如图所示.请填写下列空白:
某溶液中可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+中的一种或几种.当加入一种淡黄色固体并加热溶液时,有刺激性气体放出和白色沉淀生成,加入淡黄色固体的物质的量(横坐标)与析出沉淀和产生气体的物质的量(纵坐标)的关系,如图所示.请填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 化学在环境保护中起着十分重要的作用.催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染.
化学在环境保护中起着十分重要的作用.催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com