
| A. | 第一电离能:Li<Be<B | B. | 最高正价:O>N>C | ||
| C. | 电负性:O>C>Si | D. | 半径:K+>Cl- |
分析 A.Be元素最外层为全充满结构,较稳定;
B.F、O无正价;
C.同周期元素从左到右电负性逐渐增大,同主族从上到下电负性逐渐减小;
D.离子核外电子层数相同时,原子序数越大,离子半径越小.
解答 解:A.Be元素最外层为半充满结构,较稳定,应最大,所以第一电离能:Li<B<Be,故A错误;
B.F、O电负性较强,无正价,故B错误;
C.同周期元素从左到右电负性逐渐增大,同主族从上到下电负性逐渐减小,则有电负性:O>C>Si,故C正确;
D.离子核外电子层数相同时,原子序数越大,离子半径越小,半径:K+<Cl-,故D错误.
故选C.
点评 本题考查元素周期律知识,涉及离子半径、电负性、化合价等知识,侧重于学生的分析能力的考查,注意把握周期律的递变规律,学习中注意积累.


科目:高中化学 来源: 题型:选择题
| A. | K2=K1 | B. | K2=$\frac{1}{{K}_{1}}$ | C. | K2=K${\;}_{1}^{2}$ | D. | K2=$\frac{1}{{K}_{1}^{2}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn(s)+CuSO4(aq)═ZnSO4(aq)+Cu(s)△H=-216 kJ•mol-1,则反应物总能量>生成物总能量 | |
| B. | 相同条件下,如果1 mol氢原子所具有的能量为E1,1 mol氢分子所具有的能量为E2,则2E1=E2 | |
| C. | 101 kPa时,2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1,则H2的燃烧热为571.6 kJ•mol-1 | |
| D. | H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则含1 mol NaOH的氢氧化钠固体与含0.5 mol H2SO4 的稀硫酸混合后放出57.3 kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18 g H2O在标准状况下的体积是22.4 L | |
| B. | 22.4 L O2中一定含有6.02×1023个氧分子 | |
| C. | 在标准状况时,20 mL NH3与60 mL N2所含的原子个数比为2:3 | |
| D. | 将80 g NaOH溶于1 L水中,所得溶液中NaOH的物质的量浓度为2 moL/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能源的开发和利用情况,可以衡量一个国家或地区的科学技术水平 | |
| B. | 目前新能源主要有:煤、石油、天然气、太阳能、氢能、风能等 | |
| C. | 新能源的优点主要是资源丰富、可再生、没有或很少有污染 | |
| D. | 氢能的优点热值高、资源丰富、燃烧产物无污染;缺点是储存和运输困难 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
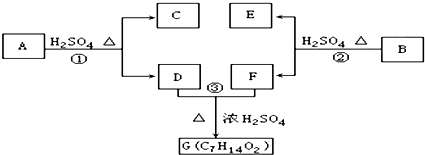
 ;
; ;
; ;写出生成G的化学方程式CH3CH2CH2COOH+
;写出生成G的化学方程式CH3CH2CH2COOH+ $→_{△}^{浓硫酸}$CH3CH2CH2COOCH(CH3)2+H2O.
$→_{△}^{浓硫酸}$CH3CH2CH2COOCH(CH3)2+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1项 | B. | 2项 | C. | 3项 | D. | 4项 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com