
【题目】教材插图具有简洁而又内涵丰富的特点。请回答以下问题:
(1)第三周期的某主族元素,其第一至第五电离能数据如图1所示。则该元素对应的原子有___种不同运动状态的电子。
(2)如图2所示.每条折线表示周期表IVA–VIIA中的某一族元素氢化物的沸点变化。请解释AsH3比NH3沸点低的原因___。
(3)CO2在高温高压下所形成的晶体其晶胞如图3所示。则该CO2晶体属于___晶体。

(4)第一电离能介于Al、P之间的第三周期元素有__种。BCl3中B原子的杂化方式为___。
(5)Fe的一种晶体如甲、乙所示,若按甲虚线方向切乙得到的A-D图示中正确的是__(填字母标号)。

铁原子的配位数是___,假设铁原子的半径是rcm,该晶体的密度是ρg/cm3,则铁的相对原子质量为___(设阿伏加德罗常数的值为NA)。
【答案】12 NH3存在分子间氢键 原子 3 sp2杂化 A 8 ![]()
【解析】
(1)根据电离能产生的突变得到最外层电子数,得到元素名称;
(2)根据晶体类型和晶体中粒子间作用力分析;
(3)根据晶胞特点分析;
(4)同周期主族元素从左到右第一电离能呈增大趋势,但第ⅡA族最外能层的s能级全满,处于稳定状态,第ⅤA族最外能层的p能级半充满,较稳定;根据杂化轨道理论求杂化类型;
(5)相对原子质量的计算利用密度公式进行。
(1)第三周期的某主族元素,根据第一至第五电离能数据,可知,该原子第二和第三电离能变化较大,产生了突变,则该原子最外层有2个电子,为镁元素,其核外有12个电子,每个电子的运动状态都不同,则有12种不同运动状态的电子;
(2) NH3分子间能形成氢键,而AsH3分子间无氢键,所以AsH3比NH3沸点低;
(3) 由CO2在高温高压下所形成的晶体的晶胞图可知,在晶胞中原子之间通过共价键结合形成空间网状结构的晶体,属于原子晶体;
(4)同周期主族元素从左到右第一电离能呈增大趋势,但第ⅡA族最外能层的s能级全满,处于稳定状态,第ⅤA族最外能层的p能级半充满,较稳定,故第三周期元素的第一电离能由大到小的顺序为Na<Al<Mg<Si<S<P<Cl<Ar,所以第一电离能介于Al、P之间的第三周期元素有3种;BCl3中B原子无孤电子对,成键电子对数为3,B的杂化方式为sp2杂化;
(5) 图甲中Fe位于顶点和体心,乙由8个甲组成,按虚线方向切乙形成的截面边长不等,排除B、D,由于每个小立方体的体心有一个铁原子,故A正确;由图甲可以看出,位于体心的铁原子周围距离最近的铁原子有8个,所以铁原子的配位数是8;
因为铁原子的半径是r cm,根据铁晶胞的结构可知,晶胞的边长为![]() ,在每个晶胞中含有铁原子的数目为1+8×
,在每个晶胞中含有铁原子的数目为1+8×![]() =2,设铁原子相对原子质量为M,根据密度=质量除以体积,可得ρ=
=2,设铁原子相对原子质量为M,根据密度=质量除以体积,可得ρ=![]() ,所以M=
,所以M=![]() 。
。


 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
【题目】为探索工业废料的再利用,某化学兴趣小组设计了如图实验方案,用含有铝、铁和铜的合金制取氯化铝、绿矾晶体(FeSO47H2O)和胆矾晶体。

请回答:
(1)步骤Ⅰ、Ⅱ、Ⅲ中均需进行的实验操作是_______________。实验室中进行该操作时,用到的玻璃仪器有烧杯、______________________。
(2)溶液A中的阴离子主要有__________________;由合金生成A溶液的离子方程式为:_______________。试剂X是________________。
(3)向溶液A中通入过量CO2气体生成固体C的离子方程式为_________________。
(4)从环境保护角度考虑,采用固体F加入足量稀硫酸里加热并鼓入空气来制备CuSO4溶液,其化学方程式是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】医用酒精和84消毒液混合使用可能发生反应:4NaClO+CH3CH2OH![]() HCCl3+HCOONa+NaCl+2NaOH+H2O,设NA为阿伏加德罗常数,下列叙述正确的是
HCCl3+HCOONa+NaCl+2NaOH+H2O,设NA为阿伏加德罗常数,下列叙述正确的是
A.含NA个ClO-的NaClO溶液中,Na+数目为NA
B.上述反应中,每生成1molNaCl,转移的电子数为8NA
C.100 g质量分数为46%的乙醇溶液中所含的氢原子数为6NA
D.标准状况下,2.24 L HCCl3含有的共用电子对的数目为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生探究如下实验(A):
实验A | 条件 | 现象 |
| 加热 | i.加热后蓝色褪去 ii.冷却过程中,溶液恢复蓝色 ⅲ.一段时间后,蓝色重又褪去 |
(1)使淀粉变蓝的物质是____。
(2)分析现象i、ii认为:在酸性条件下,加热促进淀粉水解,冷却后平衡逆向移动。
设计实验如下,“现象a”证实该分析不合理:

“现象a”是____。
(3)再次分析:加热后单质碘发生了变化,实验如下:
I:取少量碘水,加热至褪色,用淀粉溶液检验挥发出的物质,变蓝。
Ⅱ:向褪色后的溶液中滴加淀粉溶液,冷却过程中一直未变蓝;加入稀H2SO4,瞬间变蓝。
对步骤Ⅱ中稀H2SO4的作用,结合离子方程式,提出一种合理的解释:______________。
(4)探究碘水褪色后溶液的成分:
实验1:测得溶液的pH≈5
实验2:取褪色后的溶液,完成如下实验:

①产生黄色沉淀的离子方程式是____。
②Ag2O的作用是____________。
③依据上述实验,推测滤液中含有的物质(或离子)可能是_________。
(5)结合化学反应速率解释实验A中现象i、现象iii蓝色褪去的原因:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
I.氨为重要的化工原料,有广泛用途。
(1)合成氨中的氢气可由下列反应制取:
a.CH4(g)+H2O(g)![]() CO(g)+3H2(g) H1=+216.4kJ/mol
CO(g)+3H2(g) H1=+216.4kJ/mol
b.CO(g)+H2O(g)![]() CO2(g)+H2(g) H2=–41.2kJ/mol
CO2(g)+H2(g) H2=–41.2kJ/mol
则反应CH4(g)+2H2O(g)![]() CO2(g)+4H2(g)H=__。
CO2(g)+4H2(g)H=__。
(2)起始时投入氮气和氢气的物质的量分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度的关系如图。

①恒压时,反应一定达到平衡状态的标志是__(填序号)。
A.N2和H2的转化率相等
B.反应体系密度保持不变
C.![]() 保持不变
保持不变
D.![]() =2
=2
②P1__P2(填“>”“<”“=”或“不确定”,下同);反应的平衡常数:B点__D点。
③C点H2的转化率为__;在A、B两点条件下,该反应从开始到平衡时生成氮气的平均速率:v(A)___v(B)。
Ⅱ.用间接电化学法去除烟气中NO的原理如图所示。

(3)已知阴极室溶液呈酸性,则阴极的电极反应式为__。反应过程中通过质子交换膜(ab)的H+为2mol时,吸收柱中生成的气体在标准状况下的体积为__L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有mA(s)+nB(g)qC(g) △H<0的可逆反应,在一定温度下达平衡时,B的体积分数ф(B)和压强p的关系如图所示,则下列有关该反应的描述正确的是( )
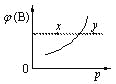
A. m+n<qB. n>q
C. x点的混合物中v (正)<v (逆)D. x点比y点的混合物的正反应速率小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电化学装置的叙述正确的是

A.图1中,Zn—MnO2干电池放电时,MnO2被氧化
B.图2中,电解精炼铜时,阳极减少的质量与阴极增加的质量一定相等
C.图3中,K分别与M、N连接,均可保护Fe电极,连接M时称为“牺牲阳极的阴极保护法”
D.图4中,在钢材上电镀铝,熔融盐中Al和Cl元素只以AlCl4-、Al2Cl7-形式存在,则阳极反应式为:Al -3e-+7AlCl4-= 4Al2Cl7-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 25℃时,向 0.1mo/L 的碳酸氢钠溶液滴几滴酚酞,呈微红色,则该溶液中
A.若滴加甲基橙溶液呈红色
B.c(HCO3-)>c(CO32-)>c(H2CO3)
C.c(OH-)=c(H+)+ c(H2CO3)- c(CO32-)
D.若加水稀释,![]() 的比值减小
的比值减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以葡萄糖为原料制得的山梨醇(A)和异山梨醇(B)都是重要的生物质转化平台化合物,E 是一种治疗心绞痛的药物。由葡萄糖为原料合成 E 的路线如下:
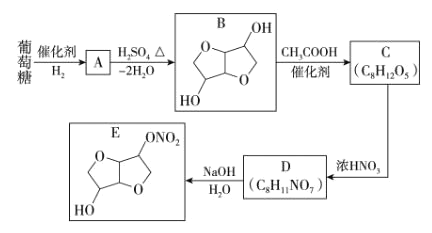
完成下列填空。
(1)A 中含有的官能团的名称为________,由 B 到 C 的反应类型为_________。
(2)写出 C 的结构简式为_____________,写出由 D 到 E 的反应方程式为 _________。
(3)设计 B 到 C 和 D 到 E 的目的是_________。
(4)F 是 B 的同分异构体,且属于二元羧酸,分子中有 3 种化学环境不同的氢原子。写出其结构简式为 _________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com