
| A、Fe(NO3)2 |
| B、ZnSO4 |
| C、NaHCO3 |
| D、NaHSO4 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蛋白质受热能发生变性,故加热能杀死流感病毒 |
| B、食品添加剂均对人体健康有害,故应禁止使用 |
| C、维生素C因具有酸性,故可做抗氧化剂 |
| D、明矾因有净水作用,故可淡化海水 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2SiO3 |
| B、Na2CO3、Na2SiO3 |
| C、Na2CO3、SiO2 |
| D、SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、c点对应的溶液中大量存在的离子可能为:Na+、Al3+、Cl-、CO32- |
| B、将25℃时的NaCl溶液加热到t℃,则该溶液中的c(OH-)由a点变化到b点 |
| C、t℃>25℃ |
| D、ac线上的任意一点均有pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
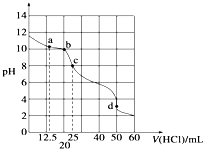 在常温下,0.100 0mol?L-1 Na2CO3溶液25mL用0.100 0mol?L-1盐酸滴定,其滴定曲线如图所示,对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是( )
在常温下,0.100 0mol?L-1 Na2CO3溶液25mL用0.100 0mol?L-1盐酸滴定,其滴定曲线如图所示,对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是( )| A、a点:c(CO32-)=c(HCO3-)>c(OH-) |
| B、b点:5c(Cl-)>4c(HCO3-)+4c(CO32-) |
| C、c点:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
| D、d点:c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、496 kJ?mol-1 |
| B、248 kJ?mol-1 |
| C、428 kJ?mol-1 |
| D、284 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com