
| 化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×108 | 4.9×10-10 | K1=4.3×10-7 K1=5.6×10-11 |
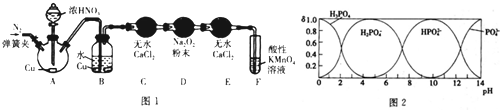
分析 (1)①Cu与浓硝酸反应生成硝酸铜、二氧化氮和水;B中二氧化氮与水反应生成硝酸,Cu与稀硝酸反应生成硝酸铜、NO和水;NO属于有毒气体,要进行尾气处理;
②装置中空气能与NO反应,实验前要排尽;
③根据题中信息可知,D装置中产物为NaNO2,NaNO2与硫酸反应会生成NO;
(2)弱酸的电离平衡常数越大,酸性越强,反之酸性越弱,酸性越弱,对应钠盐中酸根离子水解程度越大;
(3)①磷酸钠中钠离子不水解、磷酸根离子水解;向Na3PO4溶液中滴入稀盐酸后,pH从10降低到5的过程中HPO42-浓度减小、H2PO4- 浓度增大;
②NaH2PO4溶液钠离子不水解、H2PO4- 水解和电离,溶液呈酸性,溶液中存在电荷守恒和物料守恒;
③Kh═$\frac{c(HP{{O}_{4}}^{2-}).c(O{H}^{-})}{c(P{{O}_{4}}^{3-})}$.
解答 解:(1)①Cu与浓硝酸反应生成硝酸铜、二氧化氮和水,其反应的方程式为:Cu+4HNO3(浓)=Cu(NO3)2+NO2↑+2H2O;B中二氧化氮与水反应生成硝酸,Cu与稀硝酸反应生成硝酸铜、NO和水,所以溶液变蓝色,同时生成无色气体;NO能与MnO4-反应生成NO3-和Mn2+,则F装置的作用是吸收未反应的NO;
故答案为:Cu+4HNO3(浓)=Cu(NO3)2+NO2↑+2H2O;铜片逐渐溶解,溶液变为蓝色,有无色气泡产生;吸收未反应的NO;
②装置中空气能与NO反应,实验前要排尽,通入氮气能起到该作用,即将装置中的空气排净;
故答案为:将装置中的空气排净;
③根据题中信息可知,D装置中产物为NaNO2,NaNO2与硫酸反应会生成NO,要检验NaNO2,先取D装置中是产物少许于试管中,然后加稀硫酸,若产生无色气体,遇到空气变为红棕色,则产物为亚硝酸钠;
故答案为:取D装置中是产物少许于试管中,加稀硫酸,若产生无色气体,遇到空气变为红棕色,则产物为亚硝酸钠;
(2)弱酸的电离平衡常数越大,酸性越强,反之酸性越弱,酸性越弱,对应钠盐中酸根离子水解程度越大,pH相同时,盐的水解程度越大,其浓度越小,则浓度:CH3COONa>NaHCO3>NaCN>Na2CO3,则a>d>b>c;
故答案为:a>d>b>c;
(3)①磷酸钠中钠离子不水解、磷酸根离子水解,所以$\frac{c(N{a}^{+})}{c(P{{O}_{4}}^{3-})}$>3;向Na3PO4溶液中滴入稀盐酸后,pH从10降低到5的过程中HPO42-浓度减小、H2PO4- 浓度增大,所以发生的反应为 HPO42-+H+═H2PO4-,
故答案为:>;HPO42-+H+═H2PO4-;
②A、钠离子不水解,浓度最大,H2PO4-电离程度大于水解程度,溶液呈酸性,电离程度和水解程度都较小,所以溶液中存在C(Na+)>C(H2PO4-)>C(H+)>C(HPO42-)>C(H3PO4),故A正确;
B、H2PO4-电离程度大于水解程度,所以C(HPO42-)>C(H3PO4),故B错误;
C、溶液中存在电荷守恒C(H+)+C(Na+)=C(OH-)+C(H2PO4-)+2C(HPO42-)+3C(PO43-),故C错误;
D、溶液中存在物料守恒C(Na+)=C(H2PO4-)+C(HPO42-)+C(PO43-)+C(H3PO4),故D正确;
故选AD;
③PO43-+H2O?HPO42-+OH-
起始浓度(mol•L-1):0.1 0 0
变化浓度(mol•L-1):0.01 0.01 0.01
平衡浓度(mol•L-1):0.09 0.01 0.01
Kh═$\frac{c(HP{{O}_{4}}^{2-}).c(O{H}^{-})}{c(P{{O}_{4}}^{3-})}$=$\frac{0.01×0.01}{0.09}$=1.1×10 -3mol•L-1 ,
故答案为:1.1×10-3.
点评 本题考查了性质方案设计、弱电解质的电离、盐类水解,根据溶液中的溶质及其溶液酸碱性来分析解答,根据电荷守恒、物料守恒确定离子浓度大小,难点是水解平衡常数的计算,利用三段式法解答,题目难度中等.


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,用0.1000mol•L-1NaOH溶液分别滴定20.00mL0.1000mol•L-1盐酸和20.00mL 0.1000mol•L-1醋酸溶液,得到2条滴定曲线,如图所示.若以HX表示酸,下列说法正确的是( )
常温下,用0.1000mol•L-1NaOH溶液分别滴定20.00mL0.1000mol•L-1盐酸和20.00mL 0.1000mol•L-1醋酸溶液,得到2条滴定曲线,如图所示.若以HX表示酸,下列说法正确的是( )| A. | 滴定盐酸的曲线是图乙 | |
| B. | 达到B、D状态时,两溶液中离子浓度均为c(Na+)=c(X-) | |
| C. | 达到B、E状态时,反应消耗的,n(CH3COOH)>n(HCl) | |
| D. | 当0 mL<V(NaOH)<20.00 mL时,对应混合溶液中各离子浓度由大到小的顺序均为c(X-)>c(Na+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中 | |
| B. | 将氯化铁饱和溶液煮沸,以制取氢氧化铁胶体 | |
| C. | 某无色溶液中加入足量稀盐酸无明显现象,再滴加BaCl2溶液有白色沉淀生成,则原溶液中一定含有SO42- | |
| D. | 用无锈铁丝蘸取某溶液在酒精灯上灼烧,火焰呈黄色,则说明该溶液中一定不含钾离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨气液化以及液氨气化要吸热,所以氨常用于制冷剂 | |
| B. | 做红烧鱼时,常加一些食醋和料酒会更香,是因为生成少量的酯 | |
| C. | “地沟油”经过加工处理后可以用来制肥皂 | |
| D. | 利用生物方法脱除生活污水中的氮和磷,防止水体富营养化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将5mL0.02mol/L的H2SO4溶液与5mL0.02mol/LNaOH溶液充分混合,若混合后溶液的体积为10mL,则混合液的pH=2 | |
| B. | 将0.2mol/L的某一元酸HA溶液和0.1mol/LNaOH溶液等体积混合,混合液pH大于7,则反应后的混合液中:c(OH-)+c(A-)>c(H+)+c(HA) | |
| C. | pH相等的①CH3COONa ②C6H5ONa ③NaHCO3溶液中,c(Na+)大小关系:①>③>② | |
| D. | 常温下,0.1mol/L的CH3COONa和NaClO的混合溶液中:c(OH-)-c(H+)=c(HClO)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.6a g | B. | (a-3.2)g | C. | (a-1.6)g | D. | 1.6 g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com