
 在一密闭容器中加入A和B,各物质的物质的量浓度随着反应的进行,如图所示.下列说法不正确的是( )
在一密闭容器中加入A和B,各物质的物质的量浓度随着反应的进行,如图所示.下列说法不正确的是( )| A. | 该反应的化学方程式为5A+4B?4C | |
| B. | 2min时,该反应达到平衡,此时A、B、C的浓度比为5:4:4 | |
| C. | 用B的浓度变化表示2min内的速率为2mol/(L•min) | |
| D. | 2min前,正反应速率逐渐减小,逆反应速率逐渐增大 |
分析 A、根据图象可知,反应进行到2min时,物质的浓度不在发生变化,说明反应达到平衡状态,其中AB的浓度减小,C的浓度最大,其浓度的变化量分别是6mol/L-1mol/L=5mol/L、7mol/L-3mol/L=4mol/L、4mol/L-0=4mol/L,反应物生成物浓度之比等于物质的量之比,等于化学方程式计量数之比;
B、2min时,该反应达到平衡,ABC浓度分别为:1mol/L,3mol/L,4mol/L;
C、B反应的浓度变化计算得到速率=$\frac{△c}{△t}$;
D、2min前由于反应是向正反应方向移动的,反应物浓度减小,生成物浓度增大.
解答 解:A、根据图象可知,反应进行到2min时,物质的浓度不在发生变化,说明反应达到平衡状态,其中AB的浓度减小,C的浓度最大,其浓度的变化量分别是6mol/L-1mol/L=5mol/L、7mol/L-3mol/L=4mol/L、4mol/L-0=4mol/L,反应物生成物浓度之比等于物质的量之比,等于化学方程式计量数之比,所以化学方程式为,5A+4B?4C,故A正确
B、2min时,该反应达到平衡,ABC浓度分别为:1mol/L,3mol/L,4mol/L,此时A、B、C的浓度比为1:3:4,故B错误;
C、B的在2min内的浓度变化为4mol/L,反应速率=$\frac{△c}{△t}$=$\frac{4mol/L}{2min}$=2min/L,故C正确;
D、2min前由于反应是向正反应方向移动的,反应物浓度减小,生成物浓度增大,正反应速率逐渐减小,逆反应速率逐渐增大,故D正确;
故选B.
点评 本题考查了化学速率概念的计算应用,平衡图象的分析判断,理解概念实质、掌握基础知识是关键,题目较简单.


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg、Al、Cu可以分别用置换法、直接加热法和电解法冶炼得到 | |
| B. | 小苏打是制作面包等糕点的膨松剂,还是治疗胃酸过多的一种药剂 | |
| C. | S、C、Si都是自然界中含量丰富的非金属元素,三种元素的二氧化物都属于酸性氧化物,均能与碱反应而不能与酸反应 | |
| D. | 碱性氧化物都是由金属元素和氧元素组成,如K2O、CuO、Na2O、Na2O2、Mn2O7、Fe2O3等全部由金属元素和氧元素组成的,因此都为碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
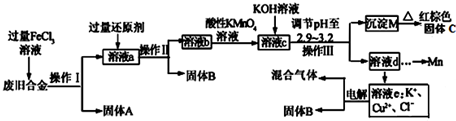
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将一定量氨气通入0.1 mol/L NH4Cl溶液中可能有:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 等物质的量的NaClO和NaHCO3的混合溶液中一定有:c(HClO)+c(ClO-)=c( HCO3-)+c( H2CO3)+c(CO32-) | |
| C. | 向CH3COONa溶液中滴加稀盐酸至溶液呈中性时有:c(Cl-)>c( Na+)>c( CH3COOH) | |
| D. | 等浓度等体积的CH3COOH溶液和CH3COONa溶液混合均匀后:c(CH3COO-)+c(CH3COOH)=c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2完全转化为SO3 | |
| B. | 消耗2 mol SO2的同时生成2 mol SO3 | |
| C. | SO2、O2与SO3的物质的量之比为2:1:2 | |
| D. | SO2、O2与SO3的浓度不再随时间变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
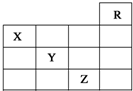 如图是元素周期表的一部分,关于元素X、Y、Z的叙述正确的是( )
如图是元素周期表的一部分,关于元素X、Y、Z的叙述正确的是( )| A. | 只有③ | B. | 只有①④ | C. | 只有①②③④ | D. | ①②③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com