
 CO+H2O,��Ӧ�����¶���ͬ������Ӧ��ʼ��Ũ�Ȳ�ͬ�����У��ף�c��H2��=c��CO2��=amol/L
CO+H2O,��Ӧ�����¶���ͬ������Ӧ��ʼ��Ũ�Ȳ�ͬ�����У��ף�c��H2��=c��CO2��=amol/L | A����>��>�� | B����>��>�� | C����>��>�� | D����>��>�� |


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 cZ(g)+dW(g)��Ӧ�ﵽƽ����������ѹ����
cZ(g)+dW(g)��Ӧ�ﵽƽ����������ѹ����| A��ƽ��������Ӧ�����ƶ� | B��(a+b)>(c+d) |
| C��Z������������ | D��X��ת���ʱ�С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CH3OH(g)
CH3OH(g)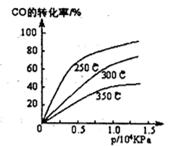
| A��������Ũ�ȼ��� |
| B������Ӧ���ʼӿ죬�淴Ӧ����Ҳ�ӿ� |
| C���״������ʵ������� |
| D������ƽ��ʱn(H2)/n(CH3OH)���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2NH3��
2NH3��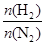 ��ʾ��ʼʱH2��N2�����ʵ���֮�ȣ�����ʼʱH2��N2�����ʵ���֮����ȡ�����ͼ����ȷ����(����)
��ʾ��ʼʱH2��N2�����ʵ���֮�ȣ�����ʼʱH2��N2�����ʵ���֮����ȡ�����ͼ����ȷ����(����)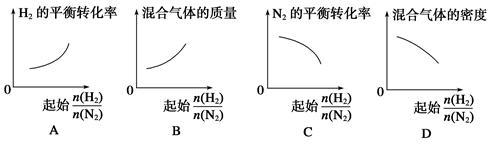
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2 CH3OCOOC2H5(g)������������ͬ��CH3OCOOCH3��ƽ��ת����(��)���¶�(T)����Ӧ����ȣ�R=n(C2H5OCOOC2H5):n(CH3OCOOCH3)���Ĺ�ϵ����ͼ��ʾ�����ַ�Ӧ����ȷֱ�Ϊ1:1��2:1��3:1������˵������ȷ����( )
2 CH3OCOOC2H5(g)������������ͬ��CH3OCOOCH3��ƽ��ת����(��)���¶�(T)����Ӧ����ȣ�R=n(C2H5OCOOC2H5):n(CH3OCOOCH3)���Ĺ�ϵ����ͼ��ʾ�����ַ�Ӧ����ȷֱ�Ϊ1:1��2:1��3:1������˵������ȷ����( )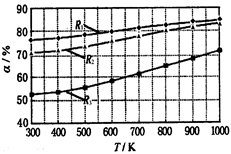
| A���÷�Ӧ��H > 0 |
| B��R1��Ӧ�ķ�Ӧ�����Ϊ3:1 |
| C��650�棬��Ӧ�����Ϊ1:1ʱ��ƽ�ⳣ��K = 6 |
| D���÷�ӦΪȡ����Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����Ϊ����������n(NH3)=1.2mol | B����Ϊ��ѹ������n(NH3) >1.2mol |
| C����Ϊ����������n(NH3)>1.2mol | D����Ϊ��ѹ������n(NH3)<1.2mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2NO2��ͨ��18O��ɵ����������´ﵽƽ�����18O
2NO2��ͨ��18O��ɵ����������´ﵽƽ�����18O| A��ֻ������O2�� |
| B��ֻ������NO2�� |
| C��ֻ������O2��NO2�� |
| D��������NO��O2��NO2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2C(g),��Ӧ��ƽ��ʱ�������������A��B�����ʵ���֮����C�����ʵ�����ȣ�����ʱA��ת����Ϊ�� ��
2C(g),��Ӧ��ƽ��ʱ�������������A��B�����ʵ���֮����C�����ʵ�����ȣ�����ʱA��ת����Ϊ�� ��| A��40% | B��50% | C��60% | D��70% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
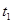 s���ƽ�⡣��ͼ��
s���ƽ�⡣��ͼ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com