
| A. | 与浓氢溴酸卤代 | B. | 与浓硫酸共热消去 | ||
| C. | 铜催化氧化 | D. | 与戊酸催化酯化 |
分析 A.醇发生溴代反应,官能团羟基被溴原子取代;
B.醇发生消去反应的条件是和羟基相连的邻碳含H原子;
C.醇催化氧化,羟基变成醛基或羰基,和羟基相连碳上无H得不能被氧化;
D.酯化反应羟基去氢,酸去羟基,剩余结合成酯.
解答 解:分子式为C5H11OH醇的同分异构体有:CH3CH2CH2CH2CH2OH;CH3CH2CH2CHOHCH3;CH3CH2CHOHCH2CH3;CH3CH(CH3)CH2CH2OH;CH3CH(CH3)CHOHCH3;CH3COH(CH3)CH2CH3;CH2OHCH(CH3)CH2CH3;CH3C(CH3)2CH2OH,共有8种情况.
A.醇发生溴代反应,官能团羟基被溴原子取代,所得产物种类和原醇相同;
B.醇发生消去反应的条件是和羟基相连的邻碳含H原子,通过消去反应得到的产物有CH2═CH-CH2-CH2-CH3、CH3-CH═CH-CH2-CH3、CH2═C(CH3)CH2CH3;CH3C(CH3)═CHCH3;CH3CH(CH3)CH═CH2共5种;
C.醇催化氧化,羟基变成醛基或羰基,和羟基相连碳上无H得不能被氧化,戊醇同分异构体中,只有CH3COH(CH3)CH2CH3不能被氧化,所得产物有7种;
D.酯化反应羟基去氢,酸去羟基,剩余结合成酯,所得产物和原醇类相同.
故所得产物异构体数目最少的为B,故选B.
点评 本题考查了同分异构体的判断,中等难度,搞清反应机理,才能正确判断产物种类.


科目:高中化学 来源: 题型:选择题

| A. | 图I表示盐酸滴加到0.1mol/L某碱溶液中得到的滴定曲线,由图I可知二者恰好中和时,所得溶液的pH=7 | |
| B. | 图II表示一定条件下进行的反应2SO2+O2?2SO3△H<0各成分的物质的量变化,t2时刻改变的条件可能是加压或降低温度 | |
| C. | 图III表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20ml Ba(OH)2溶液时,沉淀是Al(OH)3与BaSO4的混合物 | |
| D. | 图IV表示向一定体积含等浓度NH4Cl、AlCl3、MgCl2混合溶液中逐渐加入NaOH溶液至过量的过程中,生成沉淀的质量与加入NaOH溶液的体积之间的关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作及现象 | 结论 |
| A | 用铂丝蘸取某待测液在酒精灯外焰上灼烧,火焰呈紫色(透过蓝色钴玻璃) | 待测试液中一定含有钾元素,可能含钠元素 |
| B | 向某无色溶液中通入过量的CO2气体,有白色沉淀产生 | 该溶液中一定含有SiO32- |
| C | 向品红溶液中通入某气体后,溶液褪色 | 该气体一定是SO2 |
| D | 向NaOH溶液中滴加MgCl2溶液,产生白色沉淀,继续滴加FeCl3溶液产生红褐色沉淀 | Fe(OH)3的溶解度大于Mg(OH)2的溶解度 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
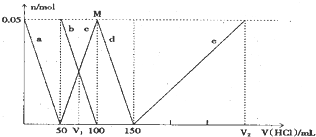
| A. | 原混合溶液中的CO32-与AlO2-的物质的量之比为1:2 | |
| B. | V1:V2=l:5 | |
| C. | M点时生成的CO2为0.05mol | |
| D. | e曲线表示的离子方程式为:Al(OH)3+3H+=Al3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HClO4、H2SO4、CH3COOH、H2CO3酸性依次减弱 | |
| B. | Cl-、Na+、Mg2+、F-的半径依次减小 | |
| C. | Na、Mg、Al失电子能力随最外层电子的增加而增强 | |
| D. | HI、HBr、HCl、HF的沸点依次降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 合理应用和处理氮的化合物,在生产生活中有重要意义.
合理应用和处理氮的化合物,在生产生活中有重要意义.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com