
 常温下有0.1mol•L-1四种溶液NaOH、NH3•H2O、HCl、CH3COOH
常温下有0.1mol•L-1四种溶液NaOH、NH3•H2O、HCl、CH3COOH分析 (1)电离度α=$\frac{已电离的醋酸分子}{醋酸分子总数}$×100%;根据溶液中的氢氧根离子计算;
(2)pH相等的醋酸和盐酸中,加水稀释促进醋酸电离,稀释相同的倍数后,醋酸中氢离子浓度大于盐酸,所以pH变化大的为强酸;
溶液的导电能力与离子浓度成正比;
(3)根据Kb(NH3•H2O)=$\frac{c(N{{H}_{4}}^{+})×c(O{H}^{-})}{(N{H}_{3}•{H}_{2}O)}$,结合c(NH3•H2O)=c(NH4+)计算.
解答 解:(1)由CH3COOH?CH3COO-+H+知,c(H+)等于已经电离的c(CH3COOH),所以已经电离的醋酸浓度是1.0×10-3mol/L,
所以α=$\frac{已电离的醋酸分子}{醋酸分子总数}$×100%=$\frac{1×1{0}^{-3}mol/L}{0.1mol/L}$×100%=1%;pH=3的醋酸溶液中,c(OH-)=$\frac{1{0}^{-14}}{0.001}$=10-11mol/L,醋酸溶液中氢氧根离子全部由水电离,而由水电离的氢离子等于水电离的氢氧根离子,则由水电离的c(H+)=10-11mol•L-1,;
故答案为:1%;10-11;
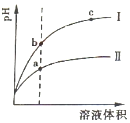
(2)pH相等的醋酸和盐酸中,加水稀释促进醋酸电离,稀释相同的倍数后,醋酸中氢离子浓度大于盐酸,所以pH变化大的为强酸,根据图象知,I为盐酸;
溶液的导电能力与离子浓度成正比,氢离子浓度越大溶液的pH越小,所以溶液导电能力较大的是a;
故答案为:?;a;
(3)已知Kb(NH3•H2O)=$\frac{c(N{{H}_{4}}^{+})×c(O{H}^{-})}{(N{H}_{3}•{H}_{2}O)}$=1.77×10-5,又因为c(NH3•H2O)=c(NH4+),则c(OH-)=1.77×10-5,所以c(H+)=$\frac{1{0}^{-14}}{1.77×1{0}^{-5}}$,则pH=9.25;
故答案为:9.25.
点评 本题考查了弱电解质的电离,根据弱电解质电离特点结合电荷守恒、物料守恒来分析解答,难点是(3)题,根据电离平衡常数计算,题目难度中等,侧重于考查学生的分析能力和计算能力.


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:选择题
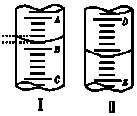 如图,图Ⅰ表示10mL量筒中液面的位置,A与B、B与C刻度间相差1mL,图II表示50mL滴定管中液面的位置,D 与E刻度间相差1mL.如果刻度A和D都是10,则两处液面的读数是( )
如图,图Ⅰ表示10mL量筒中液面的位置,A与B、B与C刻度间相差1mL,图II表示50mL滴定管中液面的位置,D 与E刻度间相差1mL.如果刻度A和D都是10,则两处液面的读数是( )| A. | Ⅰ中是9.2mL,Ⅱ中是9.40mL | B. | Ⅰ中是10.8mL,Ⅱ中是9.40mL | ||
| C. | Ⅰ中是10.8mL,Ⅱ中是10.60mL | D. | Ⅰ中是9.2mL,Ⅱ中是10.60mL |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 70℃,将0.1mol 镁粉加入到10mL6mol•L-1的硝酸溶液中 | |
| B. | 60℃,将0.2mol 镁粉加入到20mL3mol•L-1的盐酸溶液中 | |
| C. | 60℃,将0.1mol 镁粉加入到10mL3mol•L-1的硫酸溶液中 | |
| D. | 60℃,将0.2mol 铁粉加入到10mL3mol•L-1的盐酸溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物 质 | 所需试剂 | 离子方程式 |
| FeSO4(CuSO4) | ||
| Na2SO4(NaHCO3) | . |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol•L-1 | 1.00 | 0.8 | 0.64 | 0.55 | 0.5 | 0.5 |
| c(CO)/mol•L-1 | 3.50 | 3.30 | 3.14 | 3.05 | 3.00 | 3.00 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com