

分析 X遇淀粉溶液呈蓝色,则X为I2,F为暗红色液态与钾盐G反应得到I2与D,且D与硝酸银溶液得到得到不溶于稀硝酸的沉淀Y,可推知F为Br2、G为KI、D为KBr、Y为AgBr.C与钾盐D反应得到Br2与E,固体E与浓硫酸反应得到A,A与黑色粉末反应得到X,联想氯气、氯化氢制备,可知C为Cl2、D为KBr、E为KCl、A为HCl、B为MnO2,据此解答.
解答 解:X遇淀粉溶液呈蓝色,则X为I2,F为暗红色液态与钾盐G反应得到I2与D,且D与硝酸银溶液得到得到不溶于稀硝酸的沉淀Y,可推知F为Br2、G为KI、D为KBr、Y为AgBr.C与钾盐D反应得到Br2与E,固体E与浓硫酸反应得到A,A与黑色粉末反应得到X,联想氯气、氯化氢制备,可知C为Cl2、D为KBr、E为KCl、A为HCl、B为MnO2.
(1)由上述分析可知,E为KCl、F为Br2、G为KI、X为I2,故答案为:KCl;Br2;KI;I2;
(2)C+D→E+F反应方程式为:Cl2+2KBr=2KCl+Br2;
E→A的反应方程式为:KCl+H2SO4$\frac{\underline{\;微热\;}}{\;}$KHSO4+HCl↑;
F+G→D+X的反应方程式为:Br2+2KI=2KBr+I2;
D+AgNO3的反应方程式为:KBr+AgNO3=kNO3+AgBr↓,
故答案为:Cl2+2KBr=2KCl+Br2;KCl+H2SO4$\frac{\underline{\;微热\;}}{\;}$KHSO4+HCl↑;Br2+2KI=2KBr+I2;KBr+AgNO3=kNO3+AgBr↓;
(3)氧化剂氧化性强于氧化产物氧化性,故活泼性由强至弱的顺序为:Cl2>Br2>I2,还可以用Cl2、Br2、I2与氢气反应难易程度等证明,
故答案为:Cl2>Br2>I2;用Cl2、Br2、I2与氢气反应难易程度.
点评 本题考查无机物推断,注意根据颜色为突破口进行推断,需要学生熟练掌握元素化合物性质及常见制备,基本属于猜测验证型题目,难度中等.


科目:高中化学 来源: 题型:选择题
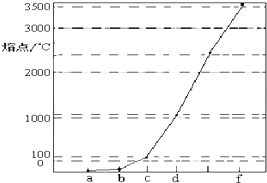
| 元素代号 | X | Y | Z | Q | R | T |
| 原子半径/10-10m | 0.77 | 0.74 | 0.75 | 1.17 | 0.99 | 1.10 |
| 主要化合价 | +4、-4 | -2 | +5、-3 | +4、-4 | +7、-1 | +5、-3 |
| A. | X与Y可以形成阴离子XY32- | |
| B. | Z的氢化物的沸点比T的氢化物的沸点高 | |
| C. | 元素R的氧化物对应的水化物一定为强酸 | |
| D. | 由X形成的化合物XY2和XR4,其中XR4的沸点高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,A既能与强酸又能与强碱反应,且都能产生气体,则A的化学式为(NH4)2S或NH4HS.
,A既能与强酸又能与强碱反应,且都能产生气体,则A的化学式为(NH4)2S或NH4HS.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无法确定NaHA溶液的酸碱性 | |
| B. | NaHA溶液中:c(H+)=c(A2-)+c(OH-) | |
| C. | 若0.1mol/L NaHA溶液的pH=2,则0.1mol/L H2A溶液中c(H+)=0.11mol/L | |
| D. | 常温下1mol/L NaHA溶液与1mol/L NaOH溶液等体积混合所得溶液pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在使石蕊试液变红的溶液中:Na+、NH4+、NO3-、AlO2- | |
| B. | 在含有较多Al3+的溶液中:Na+、K+、SO42-、HCO3- | |
| C. | 室温下,在$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液中:K+、I-、Cl-、HS- | |
| D. | 在无色溶液中:SO42-、Cl-、NH4+、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴化碘与Br2、I2具有相似的化学性质 | |
| B. | 在许多反应中,IBr是一种强氧化剂 | |
| C. | 在溴化碘与水反应中,IBr既是氧化剂,又是还原剂 | |
| D. | 溴化碘与氢氧化钠溶液反应时可生成两种盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
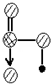 请简要说明该物质易溶于水的原因
请简要说明该物质易溶于水的原因查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com