
| A. | 钠投入水中:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 用小苏打治疗胃酸过多:CO32-+2H+=CO2↑+H2 | |
| C. | 用FeCl3溶液腐蚀印刷电路板:Fe3++Cu═Fe2++Cu2+ | |
| D. | KI溶液与H2SO4酸化的H2O2溶液混合:2I-+H2O2+2H+═2H2O+I2 |
分析 A.电荷不守恒;
B.碳酸氢根离子不能拆;
C.电荷不守恒;
D.过氧化氢酸性环境下能够氧化碘离子生成单质碘;
解答 解:A.钠投入水中,离子方程式:2Na+2H2O═2Na++2OH-+H2↑,故A错误;
B.用小苏打治疗胃酸过多,离子方程式:HCO3-+H+=CO2↑+H2O,故B错误;
C.用FeCl3溶液腐蚀印刷电路板,离子方程式:2Fe3++Cu═2Fe2++Cu2+,故C错误;
D.KI溶液与H2SO4酸化的H2O2溶液混合,离子方程式:2I-+H2O2+2H+═2H2O+I2,故D正确;
故选:D.
点评 本题考查了离子方程式书写正误判断,明确离子反应遵循原子个数守恒、电荷守恒规律即可解答,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 168 mL | B. | 224 mL | C. | 336 mL | D. | 504 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
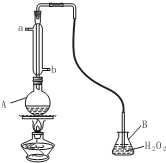 工业制硫酸尾气中的SO2,是一种空气污染物,同时也是一种重要的化工原料,采用氨吸收法进行循环利用,便可以变废为宝.
工业制硫酸尾气中的SO2,是一种空气污染物,同时也是一种重要的化工原料,采用氨吸收法进行循环利用,便可以变废为宝.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚乙炔是以乙炔为单体发生加聚反应形成的高聚物 | |
| B. | 聚乙炔的化学式为 ,其分子中所有碳原子不可能在同一直线上 ,其分子中所有碳原子不可能在同一直线上 | |
| C. | 聚乙炔是一种碳原子之间以单双键交替结合的链状结构的物质 | |
| D. | 1摩尔聚乙炔能与1摩尔Br2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 原子结构或性质 |
| A | 原子最外层电子数是内层电子总数的1/5 |
| B | 形成化合物种类最多的元素,其单质为固体 |
| C | 生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5 |
| D | 地壳中含量最多的元素 |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com