
下列离子方程式与所述事实相符且正确的是
A. 用H2O2酸性溶液,将海带灰中的I-转变为I2:H2O2+2I-=I2+2OH-
B. 漂白粉溶液在空气中失效:ClO-+CO2+H2O=HClO+HCO3-
C. 工业电解熔融氯化钠制金属钠:2Na++2Cl- 2Na+Cl2↑
2Na+Cl2↑
D. Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+=SO42-+3S↓+2H2O
科目:高中化学 来源:2016-2017学年山西省高二下学期第一次月考化学试卷(解析版) 题型:选择题
某学生用2ml1mol/L的CuSO4溶液4ml0.5mol/L的NaOH溶液混合,然后加入0.5ml4%的HCHO溶液,加热至沸腾,未见红色沉淀实验失败的主要原因( )
A.甲醛量太少 B.硫酸铜量少 C.NaOH量少 D.加热时间短
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高一3月学生学业能力调研(文)化学试卷(解析版) 题型:选择题
对于VIIA族元素,下列说法不正确的是
A. 可形成-l价离子 B. 从上到下原子半径逐渐减小
C. 从上到下原子半径逐渐增大 D. 从上到下非金属性逐渐减弱
查看答案和解析>>
科目:高中化学 来源:2017届河南省郑州、平顶山、濮阳市高三第二次质量预测(二模)理综化学试卷(解析版) 题型:简答题
碳是形成化合物种类最多的元素,其单质及化合物有独特的性质和用途。请回答下列问题。
(1)碳原子核外电子有_____种不同的运动状态。碳原子的价电子在形成sp3杂化后,其轨道表达式为_____。
(2)写出一种CO32-的等电子体微粒的化学式_______,其空问构型为_______。
(3)有机物M(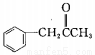 )在一定条件下生成N(
)在一定条件下生成N(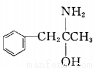 )。
)。
①沸点:M_____N (填“大于”或“小于”)。
②M中碳原子杂化类型为_____,不同杂化类型的碳原子数之比为_____。
③有机物N中除氢原子之外的其他原子的第一电离能由大到小的顺序为_____。
(4)已知CaCO3的热分解温度为900℃,SrCO3的热分解温度为1172℃,试从原子结构的角度解释CaCO3的热分解翻度低于SrCO3的原因_____________。
(5)石墨是碳的一种同素异形体,它的一种晶胞结构和部分晶胞参数如下图:
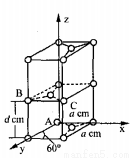
①原子坐标参数描述的是晶胞内原子间的相对位置。石墨晶胞中碳原子A、B的坐标参数分别为:A(0,0,0)、B(0,1,1/2)。则C原子的坐标参数为_______________。
②晶胞参数用以描述晶胞的大小和形状。已知石墨晶胞底边长为am ,层间距为dcm,阿伏加德罗常数的值为NA,则石墨的密度为_____g·cm-3(写出表达式即可)。
查看答案和解析>>
科目:高中化学 来源:2017届河南省郑州、平顶山、濮阳市高三第二次质量预测(二模)理综化学试卷(解析版) 题型:选择题
已知K2Cr2O7溶液中存在平衡: Cr2O72-(橙色)+H2O 2CrO42-(黄色)+2H+。保持温度不变,用K2Cr2O7溶液进行下列实验:
2CrO42-(黄色)+2H+。保持温度不变,用K2Cr2O7溶液进行下列实验:
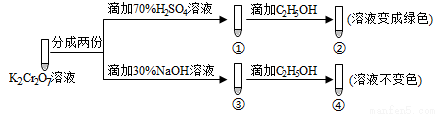
结合实验,下列说法正确的是
A. ①中溶液变黄,③中溶液橙色加深
B. 上述可逆反应的平衡常数:①<③
C. K2Cr2O7溶液的氧化性在酸性条件下更强
D. 若向④中加入70%H2S04溶液至过量,溶液变为橙色
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高二学业水平测试化学试卷(解析版) 题型:选择题
已知:MnO2+4HCl(浓)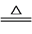 MnCl2+Cl2↑+2H2O。实验室用足量NaOH溶液吸收从浓盐酸和MnO2反应体系中导出的气体。当吸收温度不同时,生成的产物可能是NaClO、NaClO3、NaCl中的两种或三种。下列说法正确的是
MnCl2+Cl2↑+2H2O。实验室用足量NaOH溶液吸收从浓盐酸和MnO2反应体系中导出的气体。当吸收温度不同时,生成的产物可能是NaClO、NaClO3、NaCl中的两种或三种。下列说法正确的是
A. 若产物为NaClO、NaCl,则吸收后的溶液中n(ClO-)=n(Cl-)
B. 若产物为NaClO3、NaCl,则参加反应的氧化剂和还原剂的物质的量之比为1∶5
C. 若产物为NaClO、NaClO3、NaCl,则由吸收后的溶液中n(Cl-)和n(ClO-)可计算吸收的n(Cl2)
D. 若产物为NaClO、NaClO3、NaCl,则NaOH与Cl2相互反应的物质的量之比为2∶1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高二学业水平测试化学试卷(解析版) 题型:选择题
下列说法正确的是
A. 1molN2中含有的分子数为2×6.02×1023
B. 用激光笔照射CuSO4溶液可产生“丁达尔效应”
C. 常温下,铝片能溶于浓硝酸
D. 常温下,淀粉溶液遇I2变成蓝色
查看答案和解析>>
科目:高中化学 来源:2016-2017学年贵州省高一下学期第一次月考理科综合化学试卷(解析版) 题型:实验题
实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如图所示:
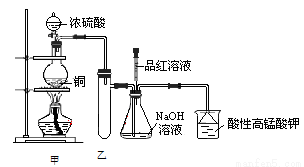
请回答:
(1)实验中取一定量Cu片和一定量浓H2SO4放在圆底烧瓶中共热,至反应结束后,发现烧瓶中还有少量Cu剩余,则H2SO4是否剩余________,原因是_____________ 。
①下列药品中,能够证明反应后烧瓶中有硫酸剩余的是________
A.Fe粉 B.BaCl2溶液 C.Ag D. 饱和NaHSO3溶液
②当向甲中反应后的溶液中通入氧气,发现铜片全部溶解,且仅生成硫酸铜溶液,则该反应的离子方程式为________________
(2)装置乙的作用是________________。
(3)请写出铜与浓硫酸反应的化学方程式___________________,浓硫酸在此反应中体现了_____________性质。
(4)下列说法正确的是________(填序号)。
a.甲装置使用的玻璃仪器有:酒精灯、玻璃管、长颈漏斗、圆底烧瓶
b.KMnO4溶液用于尾气处理
c.当把品红溶液滴入到锥形瓶中,若品红不褪色,说明无NaHSO3产生
d.当把品红溶液滴入到锥形瓶中,若品红褪色,说明NaOH已完全转化为NaHSO3
e.若把品红溶液换成酸性高锰酸钾溶液,并滴入到锥形瓶中,不显紫红色,说明NaOH已完全转化为NaHSO3
查看答案和解析>>
科目:高中化学 来源:2017届重庆市高三适应性月考(六)理综化学试卷(解析版) 题型:选择题
下列根据实验操作和现象所得出的结论,正确的是
选项 | 实验操作及现象 | 结论 |
A | 测定等物质的量浓度的Na2CO3和Na2SO3溶液的pH,前者pH比后者的大 | 作金属性:S>C |
B | 向CH2=CHCH2OH中滴加酸性KMnO4溶液,紫红色褪色 | CH2=CHCH2OH 中含有碳碳双键 |
C | 将0.1mol·L-1MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1 mol·L-1CuSO4溶液,沉淀变为浅蓝色 | 同温下,Ksp[Mg(OH)2]> Ksp[Cu(OH)2] |
D | 将某化合物在酒精灯上进行焰色反应,透过蓝色钴玻璃观察为紫色 | 该化合物一定是钾盐 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com