
| A、原子半径的大小顺序为:X>Y>Z>Q |
| B、离子半径的大小顺序为:Xm+>Yn+>Zm->Qn- |
| C、m+a=d-n |
| D、b-n=c+m |


科目:高中化学 来源: 题型:
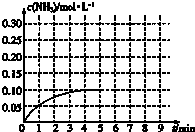 在一容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0,反应中NH3的物质的量浓度的变化情况如图:
在一容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0,反应中NH3的物质的量浓度的变化情况如图:查看答案和解析>>
科目:高中化学 来源: 题型:
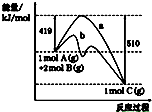
| A、正反应活化能大于逆反应活化能 |
| B、曲线b表示使用催化剂后的能量变化 |
| C、由图可知该反应的焓变△H=+91 kJ?mol-1 |
| D、反应中将气体A换为固体反应,其他条件不变,反应放出热量小于91kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、两项 | B、三项 | C、四项 | D、五项 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径:Z>X>Y |
| B、X元素形成的单质其摩尔质量一定是32g?moL-1 |
| C、物质A中既含离子键又含共价键 |
| D、YX2、ZX2都有对应的含氧酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
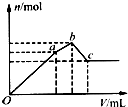 向100mL0.1mol?L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol?L-1Ba(OH)2溶液.随着Ba(OH)2溶液体积(V)的变化,沉淀总物质的量(n)的变化如图所示.下列叙述正确的是( )
向100mL0.1mol?L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol?L-1Ba(OH)2溶液.随着Ba(OH)2溶液体积(V)的变化,沉淀总物质的量(n)的变化如图所示.下列叙述正确的是( )| A、a点的沉淀总物质的量为0.03mol |
| B、Oa段发生反应的离子方程式是:Al3++2SO42-+2Ba2++3OH-═Al(OH)3↓+2BaSO4↓ |
| C、ab段发生反应的离子方程式是:2NH42++SO42-+Ba2++2OH-═2NH3?H2O+BaSO4↓ |
| D、反应到c点时,加入Ba(OH)2溶液的总体积为250mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀硝酸具有氧化性,可用于清洗做银镜反应的试管 |
| B、BaSO4、BaCO3均难溶于水,都可用作钡餐 |
| C、铝合金的大量使用归功于人们能用焦炭等还原剂从氧化铝中获取铝 |
| D、加热盛有NH4Cl固体的试管,管口有固体凝结,这是升华现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:
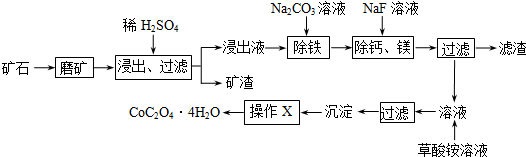

| c(Ca2+) |
| c(Mg2+) |
| 充电 |
| 放电 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com