
| A. | 0.10 mol•L-1AgNO3 | B. | 0.20 mol•L-1Zn(NO3)2 | ||
| C. | 0.20 mol•L-1Cu(NO3)2 | D. | 0.20 mol•L-1Pb(NO3)2 |
分析 在金属活动性顺序表中,当金属位于H之前时,电解可溶性盐溶液,阴极上氢离子放电生成氢气;当金属位于H之后时,电解可溶性盐溶液,阴极上先金属阳离子放电后氢离子放电,据此分析解答.
解答 解:在金属活动性顺序表中,当金属位于H之前时,电解可溶性盐溶液,阴极上氢离子放电生成氢气;当金属位于H之后时,电解可溶性盐溶液,阴极上先金属阳离子放电后氢离子放电,
A.Ag位于H之后,所以电解硝酸银溶液中银离子先放电,n(Ag+)=0.10mol/L×0.1L=0.01mol,Ag离子完全反应消耗n(e-)=0.01mol<0.04mol,所以银离子完全放电生成0.01molAg,m(Ag)=0.01mol×108g/mol=1.08g;
B.Zn位于H之前,电解硝酸锌溶液时没有金属离子放电,所以没有金属析出;
C.Cu位于H之后,电解硝酸铜溶液时铜离子先放电,n(Cu 2+)=0.2mol/L×0.1L=0.02mol,铜离子完全放电转移电子物质的量=0.02mol×2=0.04mol,所以铜离子完全放电,m(Cu)=0.02mol×64g/mol=1.28g;
D.Pb位于H之前,电解硝酸铅溶液时氢离子放电,所以没有金属析出;
通过以上分析知,析出金属质量最大的是C,
故选C.
点评 本题考查电解原理,为高频考点,侧重考查学生分析判断及计算能力,明确离子放电顺序是解本题关键,注意BD没有金属析出,为易错点.


科目:高中化学 来源: 题型:选择题
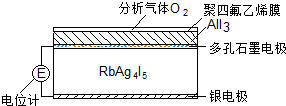 固体电解质是具有与强电解质水溶液的导电性相当的一类无机固体.这类固体通过其中的离子迁移进行电荷传递,因此又称为固体离子导体.目前固体电解质在制造全固态电池及
固体电解质是具有与强电解质水溶液的导电性相当的一类无机固体.这类固体通过其中的离子迁移进行电荷传递,因此又称为固体离子导体.目前固体电解质在制造全固态电池及| A. | 4AlI3+3O2=2Al2O3+6I2 | B. | I2+2Ag++2e-=2AgI | ||
| C. | Ag-e-=Ag+ | D. | I2+2Rb++2e-=2RbI |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2LHCl和11.2LNH3充分混合后含有的分子数为NA | |
| B. | 0.1mol 中含有碳碳双键的数目为0.4NA 中含有碳碳双键的数目为0.4NA | |
| C. | 常温常压下,1molNO2与水反应后,溶液中NO3-的数目为NA | |
| D. | 1molMg与足量空气反应生成MgO和Mg3N2,失去的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都能燃烧,生成二氧化碳和水 | |
| B. | 乙炔易发生加成反应,乙烷不能发生加成反应 | |
| C. | 都能被高锰酸钾氧化,使酸性高锰酸钾溶液褪色 | |
| D. | 相同物质的量的乙烷和乙炔,完全燃烧时生成CO2量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知25℃时部分弱电解质的电离平衡常数数据如表所示:
已知25℃时部分弱电解质的电离平衡常数数据如表所示:| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka=5.6×10-11 | Ka=3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,KW增大,pH变小 | |
| B. | 向水中加入氨水,平衡向逆反应方向移动,c(OH-)降低 | |
| C. | 向水中加入少量硫酸,c(H+)增大,KW变小 | |
| D. | 向水中加入少量固体CH3COONa,平衡向逆反应方向移动,c(H+)降低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com