
分析 常温下将0.01mol NH4Cl和0.002mol NaOH溶于水配成1L溶液,氯化铵和氢氧化钠反应生成一水合氨和氯化钠,反应的定量关系可知氯化铵过量,溶液中为NH3•H2O、NaCl、NH4Cl溶质,依据化学方程式计算判断溶液中的溶质微粒,结合电荷守恒计算判断问题;
(1)氯化铵和氢氧化钠反应生成一水合氨和氯化钠,氯化铵过量,溶液中存在铵根离子水解平衡,一水合氨形成的化学平衡,水的电离平衡;
(2)钠离子、氯离子在溶液中不发生变化,这些微粒中浓度为0.01mol/L的是Cl-,浓度为0.002mol/L的是Na+;
(3)依据物料守恒分析,氮元素守恒,溶液中氮元素的存在形式为一水合氨和铵根离子,物质的量之和为0.01mol的两种微粒是NH4+、NH3•H2O.
解答 解:常温下将0.01mol NH4Cl和0.002mol NaOH溶于水配成1L溶液,氯化铵和氢氧化钠反应生成一水合氨和氯化钠,氯化铵过量,溶液中为NH3•H2O、NaCl、NH4Cl溶质,
(1)氯化铵和氢氧化钠反应生成一水合氨和氯化钠,氯化铵过量,溶液中存在铵根离子水解平衡,NH4++H2O?NH3•H2O+H+,一水合氨是弱电解质存在电离平衡,NH3•H2O?NH4++OH-,溶液中溶剂水也是弱电解质存在电离平衡,H2O?OH-+H+,该溶液中除H2O的电离平衡外还存在的平衡体系是水解平衡,NH4++H2O?NH3•H2O+H+,一水合氨的电离平衡,NH3•H2O?NH4++OH-,
故答案为:水解平衡,NH4++H2O?NH3•H2O+H+,电离平衡,H2O?OH-+H+,电离平衡,NH3•H2O?NH4++OH-;
(2)这些微粒中,铵根离子水解,一水合氨发生电离,改变了溶液中铵根离子浓度、一水合氨浓度、氢离子浓度和氢氧根离子浓度,而氯离子、钠离子物质的量不变,所以浓度为0.01mol/L的是Cl-,浓度为0.002mol/L的是Na+;
故答案为:Cl-;Na+;
(3)物料守恒分析,0.01mol NH4Cl溶于0.002mol NaOH溶于水配成1L溶液,铵根离子结合氢氧根离子生成一水合氨,一水合氨电离书写铵根离子和氢氧根离子,根据物料守恒可知,氮元素的存在形式为NH4+、NH3•H2O,但溶液中存在的氮元素物质的量一定为1mol,则物质的量之和为0.01mol的两种微粒是NH4+、NH3•H2O;
故答案为:NH4+、NH3•H2O.
点评 本题考查了弱电解质电离,盐类水解原理,明确影响平衡移动的因素、电解质溶液中电荷守恒、物料守恒,掌握基础是关键,题目难度中等.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:多选题
| A. | 物质燃烧都是放热反应 | |
| B. | 化学反应总是伴随着能量的变化 | |
| C. | 化学反应中需要加热的反应一定是吸收反应 | |
| D. | 化学反应中放出的热量就是反应热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2S Mn(OH)2 MgCl2 H2O | |
| B. | HF KOH CO Na2CO3 | |
| C. | NH3 Al(OH)3 KBr MgO | |
| D. | H2O NaOH NH4Cl NH3﹒H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
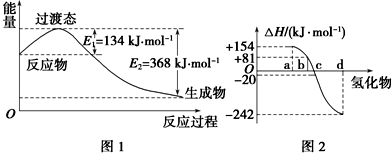
| 共价键 | H-H | Cl-Cl | H-Cl |
| 键能/(kJ•mol-1) | 436 | 247 | 434 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
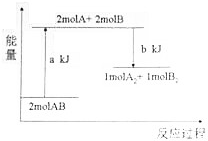
| A. | 该反应是放热反应 | |
| B. | 该反应一定要在加热条件下才能进行 | |
| C. | 断开lmolA2中的化学键和lmolB2中的化学键需吸收akJ的能量 | |
| D. | 1moIA2和1moIB2的总能量高于2molAB的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
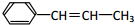 ,它可能具有的性质是( )
,它可能具有的性质是( )| A. | 易溶于水,也易溶于有机溶剂 | |
| B. | 能发生加聚反应,其生成物可用 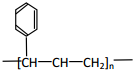 来表示 来表示 | |
| C. | 能使溴水褪色,但不能使酸性高锰酸钾褪色 | |
| D. | 可以发生加成、取代、氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解熔融态的Al2O3、12C转化为14C都属于化学变化 | |
| B. | 胆矾、冰水混合物、四氧化三铁都不是混合物 | |
| C. | 根据酸分子中含有的氢原子个数,将酸分为一元酸、二元酸和多元酸 | |
| D. | SiO2、NO2、Al2O3都属于酸性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.05 |
| 2 | 25.00 | 2.00 | 22.01 |
| 3 | 25.00 | 0.50 | 21.50 |
| 4 | 25.00 | 0.20 | 20.22 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com