
| 化合物 | PbSO4 | PbCO3 | PbS |
| 溶解度/g | 1.03×10-4 | 1.81×10-7 | 1.84×10-14 |
| A. | 碳酸盐 | B. | 硫酸盐 | C. | 硫化物 | D. | 以上沉淀剂均可 |
科目:高中化学 来源: 题型:选择题
| A. | 1molFeBr2与1molCl2反应时转移的电子数为1NA | |
| B. | 10g H218O与D216O的混合物中所含中子、电子数目均为5NA | |
| C. | 标况下,22.4L甲烷中含有C-H键数为1NA | |
| D. | pH=2的H2SO4溶液1L,含H+的数目为0.02NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:C>A | |
| B. | 离子半径:D3+>B2- | |
| C. | 非金属性:A>B | |
| D. | 最高价氧化物对应水化物的碱性:C<D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
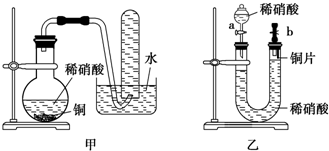
 如图装置是某种气体X的制取装置和收集装置(必要时可加热).所用的试剂从下列试剂中选取2~3种:硫化亚铁、二氧化锰、铜屑、氯化铵、稀硝酸、浓盐酸、蒸馏水.请回答下列问题:
如图装置是某种气体X的制取装置和收集装置(必要时可加热).所用的试剂从下列试剂中选取2~3种:硫化亚铁、二氧化锰、铜屑、氯化铵、稀硝酸、浓盐酸、蒸馏水.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com