
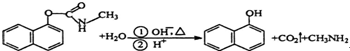
| A. | 西维因是一种芳香烃 | |
| B. | 西维因分子中所有碳原子一定共面 | |
| C. | 可用FeCl3溶液检验西维因是否发生水解 | |
| D. | 在Ni催化加热条件下西维因不能与H2加成 |
分析 A.只含C、H元素的有机化合物属于烃;
B.分子中含有肽键,具有氨气的结构特点,具有三角锥形的结构;
C.酚羟基能和酚发生显色反应;
D.苯环能和氢气在一定条件下发生加成反应.
解答 解:A.有机物含有O、N等元素,属于烃的衍生物,故A错误;
B.分子中含有肽键,具有氨气的结构特点,具有三角锥形的结构,则碳原子不可能在同一个平面上,故B错误;
C.在分子中含有酯基,在酸性条件下可生成酚羟基,可用FeCl3溶液检验是否发生水解,故C正确;
D.有机物中含有萘基,1mol西维因最多能与5mol氢气发生加成反应,故D错误.
故选C.
点评 本题考查有机物结构和性质,为高考高频点,明确物质中官能团及其性质之间的关系即可解答,难点是原子共面问题,易错选项是B,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | NH4+、Ba2+、HCO3-、Cl- | B. | K+、Al3+、S2-、ClO- | ||
| C. | Na+、Fe3+、Cl-、SO42- | D. | NH4+、Mg2+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是研究铜与浓硫酸的反应装置:
如图是研究铜与浓硫酸的反应装置:| 资料1 |
| ||||||||||||
| 资料2 | X射线晶体分析表明,铜与浓硫酸反应生成的黑色物质为Cu2S、CuS、Cu7S4中的一种或几种. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ||||||
| 3 | ① | ③ | ⑦ | ④ | ||||
| 4 | ② |
 (填电子式),该氢化物在常温下与②发生反应的化学方程式为2K+2H2O=2KOH+H2↑.
(填电子式),该氢化物在常温下与②发生反应的化学方程式为2K+2H2O=2KOH+H2↑.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应时间/min | n(CH3OH)/mol | n(CH3OCH3)/mo |
| 0 | 2.05 | 0 |
| t1 | 0.6 | |
| t2 | 0.05 |
| A. | 反应在t2 min时v正≠v逆 | |
| B. | 反应达到平衡时,放出的热量为50 kJ | |
| C. | 反应在t1 min内的平均速率为v(CH3OH)=$\frac{0.6}{{t}_{1}}$mol•L-1•min-1 | |
| D. | 若反应达到平衡后,缩小容器体积,$\frac{c(C{H}_{3}OC{H}_{3})}{c(C{H}_{3}OH)}$变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q1=Q2 | B. | Q1>Q2 | C. | Q1<Q2 | D. | 无法判断 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com