
【题目】一定量的CO2与足量碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
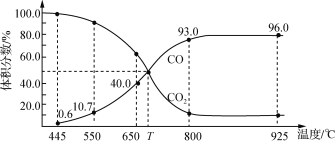
下列说法正确的是
A.650 ℃时,反应达平衡后CO2的转化率为25.0%
B.550 ℃时,若充入惰性气体,υ(正)、υ(逆)均减小,平衡不移动
C.T ℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D.925 ℃时,此反应的平衡常数K=2304,保持温度不变,若缩小体积,K值将变小
【答案】A
【解析】
A、由图可知,650℃时,反应达平衡后CO的体积分数为40%,设开始加入的二氧化碳为1mol,转化了xmol,
则有C(s)+CO2(g) ![]() 2CO(g)
2CO(g)
开始 1 0
转化 x 2x
平衡; 1-x 2x
所以![]() ×100%=40%,解得x=0.25mol,则CO2的转化率为
×100%=40%,解得x=0.25mol,则CO2的转化率为![]() ×100%=25%,选项A正确;
×100%=25%,选项A正确;
B、可变的恒压密闭容器中反应,550℃时若充入惰性气体,相当于减小压强,则υ正,υ逆均减小,又该反应是气体体积增大的反应,则平衡正向移动,选项B错误;
C、由图可知,T℃时,反应达平衡后CO和CO2的体积分数都为50%,所以若充入等体积的CO2和CO,平衡不移动,选项C错误;
D、925 ℃时,此反应的平衡常数K=2304,K只与温度有关,保持温度不变,若缩小体积,K值不变,选项D错误;
答案选A。


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:
【题目】向绝热恒容密闭容器中通入CO和H2O(g),在一定条件下使反应CO(g)+H2O(g)![]() CO2(g)+H2(g)达到平衡,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是( )
CO2(g)+H2(g)达到平衡,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是( )
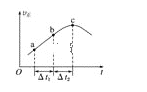
A. 反应物的总能量低于生成物的总能量
B. Δt1=Δt2时,CO的转化率:a~b段小于bc段
C. 反应在c点达到平衡状态
D. 反应物浓度:a点小于b点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用碱性溶液吸收多余的氯气,防止污染环境。若某一次兴趣小组实验中将多余的氯气用100 mL 2.00 mol·L-1的NaOH溶液恰好完全吸收。分析吸收液测得ClO-和![]() 的物质的量浓度之比为5∶1。请回答:
的物质的量浓度之比为5∶1。请回答:
(1)吸收的氯气的物质的量为____mol。
(2)若不考虑吸收前后溶液体积变化,则吸收液中Cl-的物质的量浓度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的四种短周期主族元素。由X、Y、Z、W四种元素中的几种元素形成的化合物与W、Z的单质之间的转化关系如图所示(部分产物未给出),其中Z为金属单质且与X位于不同主族,下列说法正确的是( )

A.Y和W形成的化合物YW4易溶于水
B.Y6X6燃烧时火焰明亮,且无黑烟产生
C.W的氧化物对应的水化物的酸性一定比Y的强
D.Z与W形成的化合物中只含有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)写出图1中序号①~④仪器的名称:①__;②__;③__;④__。在仪器①~④中,使用前必须检查是否漏水的有__(填仪器序号)。
(2)图2是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上(密度1.84 g·cm-3,质量分数98%)的部分内容,现用该浓硫酸配制480 mL 1 mol·L﹣1的稀硫酸。可供选用的仪器有:
①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平。
请回答下列问题:
a.图3中盛放浓硫酸的试剂瓶标签上应该印有图警示标记中的__(写标记代号A~D)。
b.配制稀硫酸时,除了上述仪器,还缺少的仪器有__、__(写仪器名称)。
c.经计算,配制480 mL 1 mol·L-1的稀硫酸,需要用量筒量取上述浓硫酸的体积为__mL(保留一位小数点)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五氧化二钒广泛用于冶金、化工等行业,用作合金添加剂、生产硫酸或石油精炼用的催化剂等。为回收利用含钒催化剂,研制了一种利用废催化剂(含有V2O5、VOSO4、不溶性硅酸盐)回收V2O5的新工艺流程如图:
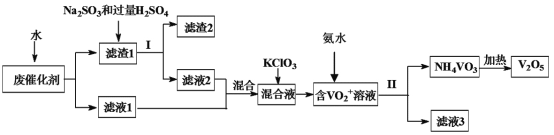
已知:(1)部分含钒物质常温下在水中的溶解性如表所示:
物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
(2)VO2++OH-![]() VO3-+H2O
VO3-+H2O
回答下列问题:
(1)用水浸泡废催化剂,为了提高单位时间内废钒的浸出率,在不加试剂情况下,可以采取的措施为__(写一条)。
(2)滤液1和滤液2中钒的存在形式相同,其存在形式为__(填离子符号)。
(3)每生成1mol(VO2)2SO4时转移电子的数目为___。
(4)在滤渣1中加入Na2SO3和过量H2SO4溶液发生反应的离子方程式为___。
(5)结合化学用语,用平衡移动原理解释加入氨水的一种作用为__。
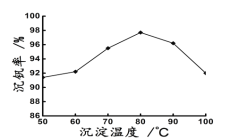
(6)新工艺流程的最后,钒以NH4VO3的形式沉淀出来;如图中横坐标表示反应II的温度,纵坐标表示沉钒率,沉钒率是指NH4VO3沉淀中V元素的质量和废催化剂中V元素的质量之比,也即是钒的回收率。请解释图中温度超过80℃以后,沉钒率下降的可能原因是___。
(7)该工艺流程中可以循环利用的物质为__。
(8)若实验室用的原料中V2O5占6%(原料中的所有钒已换算成V2O5)。取100克该废钒催化剂按工业生产的步骤进行实验。当加入100mL0.1mol/L的KClO3溶液时,溶液中的钒恰好被完全处理,假设与KClO3反应后的操作步骤中钒没有损失,则该实验中钒的回收率是__(保留3位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)FeS2(二硫化亚铁)不溶于水,可溶于适量的稀硝酸中,离子反应式如下,请配平此氧化还原反应方程式:_____FeS2+_____H++_____N![]() =______Fe2++______S+_____NO↑+______H2O。在上述氧化还原反应方程式中还原剂为_____________。
=______Fe2++______S+_____NO↑+______H2O。在上述氧化还原反应方程式中还原剂为_____________。
(2)为了验证Fe3+的性质,某化学兴趣小组设计了如图所示的一组实验,实验方案设计错误的是____________(填字母)

A.④和⑤ B.只有③ C.③和④ D.①②③
(3)已知:氧化性Cl2>Br2>Fe3+,还原性Fe2+>Br->Cl-,则向1 L 0.2 mol·L-1的FeBr2溶液中通入标准状况下氯气2.24 L,被氧化的粒子是________,此反应的离子方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学科学研究中,物质发生化学反应的反应热可通过实验测定,也可通过化学计算的方式间接地获得。
(1)实验方法测反应反应热
①中和热测定
实验中所需要使用的玻璃仪器除烧杯、量筒外还需要___________、___________。
为了减少实验误差:实验过程中将NaOH溶液________(选填“一次”或“分多次”)倒入盛有盐酸的小烧杯中;溶液混合后,准确读取混合溶液的________,记为终止温度。
②实验测定在一定温度下,0.2 molCH4(g)与足量H2O(g)完全反应生成CO2(g)和H2(g)吸收33 kJ的热量。该反应的热化学方程式_________________________________。
(2)通过化学计算间接获得
①已知拆开1mol的H—H键、I—I、H—I键分别需要吸收的能量为436kJ、153kJ、299kJ。
则反应H2(g)+I2(g)=2HI(g)的反应热△H=________kJ·mol-1
②工业生产甲醇的常用方法是:CO(g)+2H2(g)=CH3OH(g) △H=-90.8 kJ·mol-1。
已知:2H2(g)+ O2(g) = 2H2O (l) △H=-571.6 kJ·mol-1
H2(g)+![]() O2(g) = H2O(g) △H=-241.8 kJ·mol-1
O2(g) = H2O(g) △H=-241.8 kJ·mol-1
根据上述反应确定:H2燃烧热为__________kJ·mol-1;
CH3OH(g)+O2(g) = CO(g)+2H2O(g) △H=_______kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予了锂离子电池领域做出巨大贡献的三位科学家。某锂离子电池![]() 为负极,
为负极,![]() 为正极,锂盐有机溶液作电解质溶液,电池反应为
为正极,锂盐有机溶液作电解质溶液,电池反应为![]() 则下列有关说法正确的是
则下列有关说法正确的是
A.金属锂的密度、熔点和硬度均比同族的碱金属低
B.该锂离子电池可用乙醇作有机溶剂
C.电池放电时,Li+从正极流向负极
D.电池充电时,阳极的电极反应式为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com