
【题目】Ⅰ.常见的五种盐A、B、C、D、E,它们的阳离子可能是Na+、NH![]() 、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、NO
、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、NO![]() 、SO
、SO![]() 、CO
、CO![]() ,已知:
,已知:
①五种盐均溶于水,水溶液均为无色。
②D的焰色反应呈黄色。
③A的溶液呈中性,B、C、E的溶液呈酸性,D的溶液呈碱性。
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有A、C的溶液不产生沉淀。
⑤若在这五种盐的溶液中,分别加入氨水,E和C的溶液中生成沉淀,继续加氨水,C中沉淀消失。
⑥把A的溶液分别加入到B、C、E的溶液中,均能生成不溶于稀硝酸的沉淀。
请回答下列问题:
(1)五种盐中,一定没有的阳离子是__________________;所含阴离子相同的两种盐的化学式是_________________。
(2)D的化学式为 __________________,D溶液显碱性的原因是_____________________(用离子方程式表示)。
(3)A和C的溶液反应的离子方程式是_____________________;
E和氨水反应的离子方程式是_____________________________________。
Ⅱ.向100 mL FeI2溶液中逐渐通入Cl2,会依次生成I2、Fe3+、IO![]() ,其中Fe3+、I2的物质的量随n(Cl2)的变化如图所示,请回答下列问题:
,其中Fe3+、I2的物质的量随n(Cl2)的变化如图所示,请回答下列问题:

(1)由图可知,I-、Fe2+、I2三种粒子的还原性由强到弱的顺序为__________________;
(2)当n(Cl2)=0.12 mol时,溶液中的离子主要为_____________________,
从开始通入Cl2到n(Cl2)=0.12 mol时的总反应的化学方程式为_________________________
(3)当溶液中n(Cl-)∶n(IO![]() )=8∶1时,通入的Cl2在标准状况下的体积为_____________。
)=8∶1时,通入的Cl2在标准状况下的体积为_____________。
【答案】 Cu2+、Fe3+ (NH4)2SO4、Al2(SO4)3 Na2CO3 CO![]() +H2OHCO
+H2OHCO![]() +OH- Ag++Cl-===AgCl↓ Al3++3NH3·H2O===Al(OH)3↓+3NH
+OH- Ag++Cl-===AgCl↓ Al3++3NH3·H2O===Al(OH)3↓+3NH![]() I-> Fe2+_> I2 Fe2+、Fe3+、Cl- 5FeI2+6Cl2===5I2+2FeCl3+3FeCl2 8.96 L
I-> Fe2+_> I2 Fe2+、Fe3+、Cl- 5FeI2+6Cl2===5I2+2FeCl3+3FeCl2 8.96 L
【解析】I.考查离子的判断,①五种盐溶于水,得到无色溶液,说明不含Cu2+和Fe3+,②D的焰色反应呈黄色,说明D中含有Na+,且D的水溶液显碱性,即D为Na2CO3,根据信息⑤,加入氨水,只有E和C出现沉淀,且继续加入氨水,C中沉淀消失,说明C中含有Ag+,根据离子共存,C为AgNO3,E中含有Al3+,根据信息③A的溶液显中性,即A中含有Ba2+,则B中含有NH4+,根据信息⑥不溶于硝酸的沉淀是AgCl和BaSO4,因此确认A为BaCl2,B为(NH4)2SO4,E为Al2(SO4)3,(1)根据上述分子一定不含有阳离子是Cu2+和Fe3+;含有阴离子相同的两种盐是(NH4)2SO4和Al2(SO4)3;(2)根据上述分析,D为Na2CO3;Na2CO3属于强碱弱酸盐,CO32-发生水解,即CO32-+H2O ![]() HCO3-+OH-;(3)A和C反应的离子方程式为Ag++Cl-=AgCl↓;Al3++3NH3·H2O=Al(OH)2↓+3NH4+;II.考查氧化还原反应的规律以及有关氧化还原反应的计算,(1)根据氯气与物质的量的关系,I-先被氧化,紧接着是Fe2+,最后是I2,根据氧化还原反应的规律,还原性强的先被氧化,即三者的还原性是I->Fe2+>I2;(2)发生反应的离子方程式为2I-+Cl2=2Cl-+I2、2Fe2++Cl2=2Cl-+2Fe3+,5Cl2+I2+6H2O=10Cl-+2IO3-+12H+,根据图像,当通入0.12mol氯气时,I-完全反应,Fe2+部分参与反应,即溶液中的离子是Fe2+、Fe3+、Cl-;当通入0.12molCl2时,产生0.1molI2,消耗氯气的物质的量为0.1mol,根据碘元素守恒,FeI2的物质的量为0.1mol,还剩下0.02mol氯气,消耗Fe2+的物质的量为0.04mol,即Fe3+的物质的量为0.04mol,溶液还剩下Fe2+的物质的量(0.1-0.04)mol=0.06mol,因此根据物质的量之比,因此总反应方程式为5FeI2+6Cl2=5I2+2FeCl3+3FeCl2;(3)设发生5Cl2+I2+6H2O=10Cl-+2IO3-+12H+,消耗碘单质的物质的量为xmol,此时溶液中n(IO3-)=2xmol,溶液中n(Cl-)=(10x+0.1×2+0.1)mol,根据题意有:(10x+0.1×2+0.1):2x=8:1,解得x=0.05mol,因此通入氯气的体积为(10×0.05+0.2+01)×22.4/2L=8.96L。
HCO3-+OH-;(3)A和C反应的离子方程式为Ag++Cl-=AgCl↓;Al3++3NH3·H2O=Al(OH)2↓+3NH4+;II.考查氧化还原反应的规律以及有关氧化还原反应的计算,(1)根据氯气与物质的量的关系,I-先被氧化,紧接着是Fe2+,最后是I2,根据氧化还原反应的规律,还原性强的先被氧化,即三者的还原性是I->Fe2+>I2;(2)发生反应的离子方程式为2I-+Cl2=2Cl-+I2、2Fe2++Cl2=2Cl-+2Fe3+,5Cl2+I2+6H2O=10Cl-+2IO3-+12H+,根据图像,当通入0.12mol氯气时,I-完全反应,Fe2+部分参与反应,即溶液中的离子是Fe2+、Fe3+、Cl-;当通入0.12molCl2时,产生0.1molI2,消耗氯气的物质的量为0.1mol,根据碘元素守恒,FeI2的物质的量为0.1mol,还剩下0.02mol氯气,消耗Fe2+的物质的量为0.04mol,即Fe3+的物质的量为0.04mol,溶液还剩下Fe2+的物质的量(0.1-0.04)mol=0.06mol,因此根据物质的量之比,因此总反应方程式为5FeI2+6Cl2=5I2+2FeCl3+3FeCl2;(3)设发生5Cl2+I2+6H2O=10Cl-+2IO3-+12H+,消耗碘单质的物质的量为xmol,此时溶液中n(IO3-)=2xmol,溶液中n(Cl-)=(10x+0.1×2+0.1)mol,根据题意有:(10x+0.1×2+0.1):2x=8:1,解得x=0.05mol,因此通入氯气的体积为(10×0.05+0.2+01)×22.4/2L=8.96L。


科目:高中化学 来源: 题型:
【题目】下列关于F、Cl、Br、I性质的比较,不正确的是( )
A.单质的颜色随核电荷数的增加而加深
B.单质的熔、沸点随核电荷数的增加而升高
C.单质的氧化性减弱
D.它们的氢化物的稳定性随核电荷数的增加而增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 向明矾溶液中加入过量的氢氧化钡溶液: ![]()
B. 向氢氧化亚铁中加入足量的稀硝酸: ![]()
C. 向磷酸二氢铵溶液中加入足量的氢氧化钠溶液:![]()
D. 向![]() 中加入足量的氢氧化钠溶液并加热:
中加入足量的氢氧化钠溶液并加热: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素。其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置如下图。下列说法正确的是
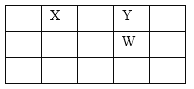
A. 五种元素中,原子半径最大的是W
B. Y与Z形成的化合物均为碱性氧化物
C. Y、Q、W形成的气态氢化物中,沸点最高的是H2Y
D. Z与Q形成的化合物水溶液一定显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体V L(标准状况),向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0g,若上述气体为NO和NO2的混合物,且体积比为1:1,则V可能为( )
A.9.0 L B.13.5 L C.15.7 L D.16.8 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴化钙晶体(CaBr2·2H2O)为白色固体,易溶于水,可用于制造灭火剂、制冷剂等。一种制备溴化钙晶体的工艺流程如下:

(1)实验室模拟海水提溴的过程中,用苯萃取溶液中的溴,分离溴的苯溶液与水层的操作是(装置如下图):使玻璃塞上的凹槽对准漏斗上的小孔,将活塞拧开,使下面的水层慢慢流下,待有机层和水层界面与活塞上口相切即关闭活塞,______________。

(2)“合成”的化学方程式为___________________。 “合成”温度控制在70℃以下,其原因是__________。投料时控制n(Br2):n(NH3)= 1:0.8,其目的是__________________。
(3)“滤渣”的主要成分为_________________(填化学式)。
(4)“滤液”呈强碱性,其中含有少量BrO-、BrO3-,请补充从“滤液”中提取CaBr2·2H2O的实验操作:加热驱除多余的氨,______________。[实验中须使用的试剂有:氢溴酸、活性炭、乙醇;除常用仪器外须使用的仪器有:砂芯漏斗,真空干燥箱]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】保护环境、保护地球已成为人类共同的呼声。
(1)下列措施不利于环境保护的是___________(选填字母,下同)
A.推广使用无铅汽油 B.提倡家庭使用太阳能热水器
C.推广废旧电池单独回收 D.提倡家庭购买大排量汽车
(2)酸雨的PH<5.6,下列气体排放可能形成酸雨的是______________
A.N2 B.CO C.SO2 D.氟氯代烷
(3)下列情况可能引起大气污染的是____________
①煤的燃烧 ②工业废气任意排放 ③燃放鞭炮 ④飞机、汽车尾气的排放
A.只有①② B.只有②④
C.只有①②③ D.①②③④
(4)废弃的热塑性塑料通过清洗、熔融、重新制成塑料。塑料属于____________
A.无机非金属材料 B.有机合成材料
C.复合材料 D.合金
(5)维生素C又称为抗坏血酸,在人体内有重要功能,其结构简式如右图所示,则维生素C的分子式为__________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com