
明矾石是制取钾肥和氢氧化铝的重要原料,明矾石的组成和明矾相似,此外还含有氧化铝和少量的氧化铁杂质。具体实验流程如下:
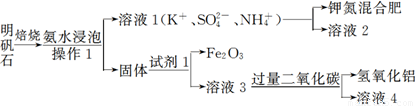
请回答下列问题:
(1)操作1所用到的玻璃仪器的名称是____________。
(2)由溶液3制取氢氧化铝的离子方程式为 。
(3)请你写出验证溶液1中有NH4+的实验过程:_______________________________________________。
(4)实验室用Fe2O3与CO反应来制取单质Fe。
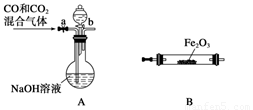
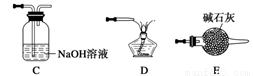
①请按气流由左到右的方向连接下列各装置,顺序为A→ 。
②检查装置A气密性的方法是 。
③在点燃B处的酒精灯前,应进行的操作是_______________________________________;④装置C的作用是________________。
(1)玻璃棒、烧杯和漏斗 (1分)
(2)由流程图可知试剂1应为NaOH溶液,故反应为AlO2-+2H2O+CO2=Al(OH)3↓+HCO3- (2分)
(3)取少量溶液1,加入浓NaOH溶液后加热,有能使湿润的红色石蕊试纸变蓝的气体产生,证明有NH4+ (其他合理答案也可) (2分)
(4) ①E→B→C→D (1分)
②将导气管插入水槽中,关闭弹簧夹a和活塞b,微热圆底烧瓶,导管口有气泡产生,撤去热源,导管中形成一段水柱 (2分)
③检查CO的纯度 (1分)
④除去CO中的CO2,有利于点燃CO (1分)
【解析】
试题分析:(1)操作I为过滤,故用到的仪器为玻璃棒、烧杯和漏斗
(2) 由流程图可知试剂1应为NaOH溶液,故反应为AlO2-+2H2O+CO2=Al(OH)3↓+HCO3-
(3)操作为:取少量溶液1,加入浓NaOH溶液后加热,有能使湿润的红色石蕊试纸变蓝的气体产生,证明有NH4+ (其他合理答案也可)
(4)① 由题上提供的装置图及进入B装置之前的CO必须纯净,CO尾气只能通过点燃,因含有CO2不易燃烧,故点燃之前应除去CO2故操作顺序为E→B→C→D
②检查装置气密性的方法为:将导气管插入水槽中,关闭弹簧夹a和活塞b,微热圆底烧瓶,导管口有气泡产生,撤去热源,导管中形成一段水柱
③不纯的CO燃烧容易爆炸,故检查CO的纯度
④除去CO中的CO2,有利于点燃CO
考点:考查物质的转化及性质,实验基本操作等相关知识。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解


查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| (m-132n) |
| 42 |
| (m-132n) |
| 42 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
明矾石是制取钾肥和氢氧化铝的重要原料,明矾石的组成和明矾相似,此外还含有氧化铝和少量氧化铁杂质。具体实验步骤如下图所示:

根据上述图示,完成下列填空:
(1)明矾石焙烧后用稀氨水浸出。配制500mL稀氨水(每升含有39.20g氨)需要取浓氨水(每升含有251.28g氨)__________mL,用规格为_______mL量筒量取。
(2)氨水浸出后得到固体混合体系,过滤,滤液中除K+、SO42-外,还有大量的NH4+。检验NH4+的方法是______________________________________________。
(3)写出沉淀物中所有物质的化学式________________________________________。
(4)滤液I的成分是水和______________。
(5)为测定混合肥料K2SO4、(NH4)2SO4中钾的含量,请完善下列步骤:
①称取钾氮肥试样并溶于水,加入足量______溶液,产生白色沉淀。
②___________、__________、_________(依次填写实验操作名称)。
③冷却、称重。
(6)若试样为mg,沉淀的物质的量为nmol,则试样中K2SO4的物质的量为:___________mol(用含有m、n的代数式表示)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年福建省漳州市七校高三第二次联考化学试卷(解析版) 题型:填空题
明矾石是制取钾肥和氢氧化铝的重要原料,明矾石的组成和明矾[KAl(SO4)2?12H2O]相似,此外还含有氧化铝和少量氧化铁杂质。具体实验步骤如下图所示:

根据上述图示,完成下列填空:
(1)明矾石焙烧后用稀氨水浸出。配制500ml稀氨水(每升含有39.00g氨)需要取浓氨水(每升含有250g氨)__________ml,用规格为_______ml量筒量取。
(2)氨水浸出后得到固体混合体系,过滤,滤液中除K+、SO42-外,还有大量的NH4+。检验NH4+的方法是_______________________________________________________。
(3)写出沉淀物中所有物质的化学式________________________________________。
(4)滤液的成分是水和______________。
(5)为测定混合肥料K2SO4、(NH4)2SO4中钾的含量,请完善下列步骤:
①称取钾氮肥试样并溶于水,加入足量______溶液,产生白色沉淀。②_______、______、干燥(填实验操作名称)。③冷却、称重。
(6)若试样为mg,沉淀的物质的量为n mol,则试样中K2SO4的物质的量为:______(用含有m、n的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com