
按如图所示进行铁腐蚀的实验,一周后观察:
 (1)若试管中液面上升,发生的是________腐蚀,电极反应为:
(1)若试管中液面上升,发生的是________腐蚀,电极反应为:
正极_________________________________________________________;
负极___________________________________________________________。
(2)若试管中液面下降,发生的是____________腐蚀,电极反应为:正极
________________________________________________________________________;
负极________________________________________________________________________。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键)。
(1)该物质的结构简式为
________________________________________________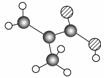 ________________________。
________________________。
(2)该物质中所含官能团的名称为________________________。
(3)下列物质中,与该产品互为同系物的是(填序号)________,互为同分异构体的是__________。
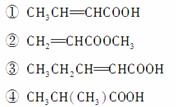
查看答案和解析>>
科目:高中化学 来源: 题型:
烧过菜的铁锅未及时洗涤(残液中含NaCl等),第二天便出现红棕色锈斑。下列反应表示整个过程可能发生的变化,其中不符合事实的是( )
A.2H2O+O2+4e-===4OH-
B.Fe-3e-===Fe3+
C.Fe2++2OH-===Fe(OH)2↓
D.4Fe(OH)2+O2+2H2O===4Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
有A、B、C、D四块金属片,进行如下实验:①A、B用导线相连后,同时浸入稀硫酸溶液中,A为负极;②C、D用导线相连后,同时浸入稀硫酸溶液中,电流由D—→导线—→C;③A、C相连后,同时浸入稀硫酸溶液中,C极产生大量气泡;④B、D用导线相连后,同时浸入稀硫酸溶液中,D极发生氧化反应。据此,判断四种金属的活动性顺序是( )
A.A>B>C>D B.A>C>D>B
C.C>A>B>D D.B>D>C>A
查看答案和解析>>
科目:高中化学 来源: 题型:
无水AlCl3可用作有机合成的催化剂、食品膨松剂等。工业上由铝土矿(主要成分是A12O3和Fe2O3)和石油焦(主要成分是C)按下图所示流程进行一系列反应来制备无水AlCl3。
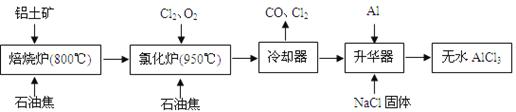
(1)氯化铝在加热条件下易升华,气态氯化铝的化学式为Al2Cl6,每种元素的原子最外层均达到8电子稳定结构,则AlCl3是 晶体,其结构式为 。
(2)氯化炉中Al2O3、Cl2和C反应的化学方程式是 。
(3)冷却器排出的尾气中含有大量CO和少量Cl2,需用Na2SO3溶液除去Cl2,此反应的离子方程式为: 。
(4)升华器中主要含有AlCl3和FeCl3,需加入少量Al,其作用是: 。
(5)AlCl3产品中Fe元素含量直接影响其品质,为测定产品中Fe元素的含量,现称取16.25g无水AlCl3产品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重残留固体质量为0.32g。则产品中Fe元素的含量为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是
A. 铝溶于NaOH溶液:Al+2OH—=AlO2—+H2↑
B. 铜溶于稀硝酸:3Cu+ 8H+ +2NO3—=3Cu2+ +2NO↑ + 4H2O
C. 碳酸镁中滴加稀盐酸:CO32—+2H+ =CO2↑ + H2O
D. 稀硫酸中滴加氢氧化钡溶液:H++ OH—=H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
常见元素A、B、M组成的四种物质发生反应:甲+乙 丙+丁,其中甲由A和M组成,乙由B和M组成,丙只含M。
(1)若甲为淡黄色固体,乙和丙均为常温下的无色无味气体。则甲的电子式为 ;生成标准状况下5.6L丙转移移电子数为 ;常温下丁溶液pH 7,用离子方程式解释 。
(2)若丁为能使品红褪色的无色气体,丙为常见紫红色金属,化合物甲、乙中原子个数比均为1:2(M均显+1价),原子序数B大于A。则:
①A在周期表中位置为
②将丁通至FeCl3溶液中的现象为
离子反应方程式为
③正确书写上述生成丙的化学方程式
④向MCl2的溶液中通入丁,可观察到白色的MC1沉淀,写出该反应的离子方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com