
分析 Ⅰ:依据热化学方程式和盖斯定律计算得到,燃烧热是1mol物质完全燃烧生成稳定氧化物放出的热量表示热化学方程式;
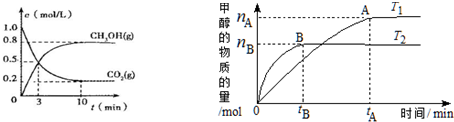
Ⅱ、(1)由图T2>T1,而温度越高甲醇的量越少,说明平衡逆向移动,所以逆反应是吸热反应;
(2)根据反应速率v=$\frac{△c}{△t}$计算v(CO2),再根据速率之比等于化学计量数之比计算v(H2);
(3)A、无论反应是否达到平衡状态,n(CH3OH):n(H2O)为1:1;
B、当反应前后改变的物理量不变时,该反应达到平衡状态;
C、根据“先拐先平数值大”判断;
D、升高温度平衡逆向移动,达到平衡时$\frac{n(H2)}{n(CH3OH)}$增大;
(4)化学平衡正向移动可增加甲醇产率,由此分析各项;
(5)根据三行式求平衡时各组分的浓度,然后代入表达式计算;
(6)根据CO2的转化率求得平衡时各物质的物质的量,压强之比等于物质的量之比,从而求得结论.
解答 解:Ⅰ:①H2O(l)═H2O(g)△H=+44.0kJ.mol-1
②2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-1275.6kJ•mol-1
依据盖斯定律②+①×2得到2CH3OH(g)+3 O2(g)=2CO2(g)+4H2O(l)△H=-1451.6kJ/mol
CH3OH(g)+$\frac{3}{2}$ O2(g)=CO2(g)+2H2O(l)△H=-725.8kJ/mol,
故答案为:CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-725.8kJ/mol;
Ⅱ、(1)由图T2>T1,而温度越高甲醇的量越少,说明平衡逆向移动,所以逆反应是吸热反应,正反应是放热反应,所以△H1<0,故答案为:<;
(2)从反应开始到平衡,v(CO2)=$\frac{1mol/L-0.2mol/L}{10min}$=0.08mol•L-1•min-1,速率之比等于化学计量数之比,故v(H2)=3×0.08mol•L-1•min-1=0.24 mol•L-1•min-1,故答案为:0.24 mol•L-1•min-1;
(3)A、若保持恒温,无论该反应是否达到平衡状态,容器中n(CH3OH):n(H2O)始终为1:1,所以不能据此判断平衡状态,故错误;
B、该反应是反应气体体积减小的反应,若保持恒温,当容器内气体压强恒定时,该反应已达平衡状态,故正确;
C、根据“先拐先平数值大”知T1<T2,升高温度,甲醇的物质的量减小,则平衡向逆反应发现移动,所以平衡常数:K(T1)>K (T2),故错误;
D、升高温度平衡逆向移动,达到平衡时$\frac{n(H2)}{n(CH3OH)}$增大,故正确;
故选BD;
(4)A.增加CO2的量,平衡正向移动,甲醇产率增加,故正确;
B.正反应是放热反应,升高温度,平衡逆向移动,甲醇产率减小,故错误;
C.充入He,使体系总压强增大,各组分浓度不变,平衡不移动,甲醇产率不变,故错误;
D.按原比例再充入CO2和H2,相当于增大压强,平衡正向移动,甲醇产率增加,故正确;故选AD;
(5)CO(g)+2H2(g)?CH3OH(g)
初起:2mol/L 6mol/L 0
变化:1.5mol•L-13mol•L-1 1.5mol•L-1
平衡:0.5mol•L-1 3mol•L-11.5mol•L-1
所以K=$\frac{1.5}{0.5×{3}^{2}}$=0.33,
故答案为:0.33;
(6)由化学平衡的三段模式法计算可知,
CO2 (g)+3H2(g)=CH3OH(g)+H2O(g)
起始 1 3 0 0
变化 A 3A A A
平衡 1-A 3-3A A A
根据相同条件下气体的压强之比等于物质的量之比,
则容器内的压强与起始压强之比为=(1-A+3-3A+A+A):(1+3)=(2-A):2=1-0.5A,故答案为:1-0.5A.
点评 本题是一道关于化学平衡状态的判断、化学平衡的移动影响因素,平衡状态的判断方法,要求学生具有分析和解决问题的能力,难度中等.


科目:高中化学 来源: 题型:多选题

| A. | ①② | B. | ②④ | C. | ③④ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 室温下,在0.2mol•L-1 Al2(SO4)3溶液中,逐滴加入1.0mol•L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如图,下列有关说法正确的是( )
室温下,在0.2mol•L-1 Al2(SO4)3溶液中,逐滴加入1.0mol•L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如图,下列有关说法正确的是( )| A. | 0→c段,发生反应的离子方程式为:Al3++4OH-═[Al(OH)4]- | |
| B. | a-b段,溶液pH增大,Al3+浓度不变 | |
| C. | b-c段,加入的OH-主要用于生成Al(OH)3沉淀 | |
| D. | d点时,Al(OH)3沉淀开始溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 处理过程中银器一直保持恒重 | |
| B. | 正极的电极反应为Ag2S-2e-═2Ag++S | |
| C. | 该过程中铝是负极,发生氧化反应 | |
| D. | 黑色褪去的原因是黑色Ag2S转化为白色AgCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 锰及其化合物在现代工业及国防建设中具有十分重要的地位.
锰及其化合物在现代工业及国防建设中具有十分重要的地位.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
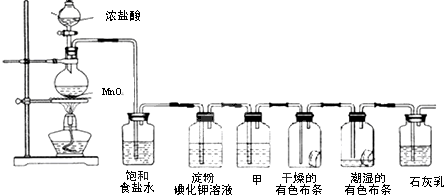
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com