
【题目】对羟基扁桃酸是农药、药物、香料合成的重要中间体,它可由苯酚和乙醛酸在一定条件下反应制得:
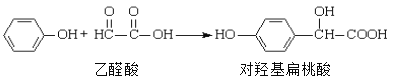
下列说法不正确的是
A. 上述反应的原子利用率可达到100%
B. 在核磁共振氢谱中对羟基扁桃酸应该有6个吸收峰
C. 1mol对羟基扁桃酸与足量NaOH溶液反应,消耗3 mol NaOH
D. 可以用FeCl3溶液鉴别乙醛酸和苯酚
 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
【题目】H2S和SO2会对环境和人体健康带来极大的危害,工业上采取多种方法减少这些有害气体的排放,回答下列各方法中的问题。
Ⅰ.H2S的除去
方法1:生物脱H2S的原理为:
H2S+Fe2(SO4)3![]() S↓+2FeSO4+H2SO4
S↓+2FeSO4+H2SO4
4FeSO4+O2+2H2SO4![]() 2Fe2(SO4)3+2H2O
2Fe2(SO4)3+2H2O
(1)硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍,该菌的作用是______________。
(2)由图3和图4判断使用硫杆菌的最佳条件为______________。若反应温度过高,反应速率下降,其原因是______________。

方法2:在一定条件下,用H2O2氧化H2S
(3)随着参加反应的n(H2O2)/n(H2S)变化,氧化产物不同。当n(H2O2)/n(H2S)=4时,氧化产物的分子式为__________。
Ⅱ.SO2的除去
方法1(双碱法):用NaOH吸收SO2,并用CaO使NaOH再生
NaOH溶液![]() Na2SO3
Na2SO3
(4)写出过程①的离子方程式:____________________________;CaO在水中存在如下转化:
CaO(s)+H2O (l) ![]() Ca(OH)2(s)
Ca(OH)2(s)![]() Ca2+(aq)+2OH(aq)
Ca2+(aq)+2OH(aq)
从平衡移动的角度,简述过程②NaOH再生的原理____________________________________。
方法2:用氨水除去SO2
(5)已知25℃,NH3·H2O的Kb=1.8×105,H2SO3的Ka1=1.3×102,Ka2=6.2×108。若氨水的浓度为2.0 mol·L-1,溶液中的c(OH)=_________________mol·L1。将SO2通入该氨水中,当c(OH)降至1.0×107 mol·L1时,溶液中的c(![]() )/c(
)/c(![]() )=___________________。
)=___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s)![]() 2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示。
2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示。
压强/MPa 体积分数/% 温度/℃ | 1.0 | 2.0 | 3.0 |
810 | 54.0 | a | b |
915 | c | 75.0 | d |
1000 | e | f | 83.0 |
①b<f ②915℃、2.0MPa时E的转化率为60% ③该反应的ΔS>0 ④K(1000℃)>K(810℃)
上述①~④中正确的有( )
A.4个B.3个C.2个D.1个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )

下列图示与对应的叙述符合的是( )
A.图甲实线、虚线分别表示某可逆反应未使用催化剂和使用催化剂的正、逆反应速率随时间的变化
B.图乙表示反应2SO2(g)+O2(g) ![]() 2SO3(g)△H<0的平衡常数K与温度和压强的关系
2SO3(g)△H<0的平衡常数K与温度和压强的关系
C.图丙表示向0.1mol/L的NH4Cl溶液中滴加0.1mol/L的HCl溶液时,溶液中 随HCl溶液体积变化关系
随HCl溶液体积变化关系
D.图丁表示常温下向20mL pH=3的醋酸中滴加pH=11的NaOH溶液,溶液的pH随NaOH溶液体积的变化关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察1s轨道电子云示意图,判断下列说法正确的是( )

A.一个小黑点表示1个自由运动的电子,图中有无数个电子
B.1s轨道的电子云形状为圆形的面
C.电子在1s轨道上运动像地球围绕太阳旋转
D.1s轨道电子云的点的疏密表示电子在某一位置出现概率的多少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是
A.78g Na2O2固体含有离子的数目为4NA
B.由水电离出的c(H+)=1012mol·L1溶液中Na+、NH4+、SO42、NO3 一定能大量共存
C.硫酸酸化的KI淀粉溶液久置后变蓝的反应为:4I+O2+4H+=2I2+2H2O
D.将充有NO2的玻璃球浸到热水中气体颜色加深说明2NO2(g)![]() N2O4(g) △H >0
N2O4(g) △H >0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年10月9日诺贝尔化学奖授予对锂电池方面研究有贡献的三位科学家。磷酸铁锂电池是绿色环保型电池,电池的总反应为:Li1-xFePO4+LixC6= LiFePO4+C6。磷酸亚铁锂(LiFePO4)可用作锂离子电池正极材料,文献报道可采用FeCl3、NH4H2PO4、LiCl和苯胺等作为原料制备。
(1)基态Li原子中,核外电子排布式为_______,占据的最高能层的符号是_______。
(2)该电池总反应中涉及第二周期的元素的第一电离能由大到小的顺序是_______(用元素符号表示)。
(3)FeCl3和LiFePO4中的铁元素显+3、+2价,请从原子结构角度解释Fe为何能显+3、+2价_______。
(4)苯胺(![]() )与甲苯(
)与甲苯(![]() )的相对分子质量相近,但苯胺的熔点(5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(95.0℃)、沸点(110.6℃), 原因是_______。
)的相对分子质量相近,但苯胺的熔点(5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(95.0℃)、沸点(110.6℃), 原因是_______。
(5)NH4H2PO4中,NH4+的空间构型为_______。与PO43-互为等电子体的分子或离子有_______(写两种),PO43-中磷原子杂化轨道类型为_______。
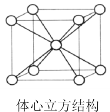
(6)锂晶体为A2型密堆积即体心立方结构(见图),晶胞中锂的配位数为_______。若晶胞边长为a pm,则锂原子的半径r为_______ pm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数依次增大的四种短周期元素,其中Z为金属元素,X、W为同一主族元素。X、Z、W形成的最高价氧化物分别为甲、乙、丙。x、y2、z、w分别为X、Y、Z、W的单质,丁是化合物。其转化关系如图所示,下列判断错误的是( )

A. 反应①、②、③都属于氧化还原反应 B. X、Y、Z、W四种元素中,Y的原子半径最小
C. Na着火时,可用甲扑灭 D. 一定条件下,x与甲反应生成丁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:2H2(g)+O2(g)=2H2O(g)ΔH=-483.6 kJ·mol-1,H2(g)+![]() O2(g)=H2O(g)ΔH=-241.8 kJ·mol-1,2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1,则氢气的燃烧热是( )
O2(g)=H2O(g)ΔH=-241.8 kJ·mol-1,2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1,则氢气的燃烧热是( )
A.483.6 kJ·mol-1B.241.8 kJ·mol-1C.571.6 kJ·mol-1D.285.8 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com