
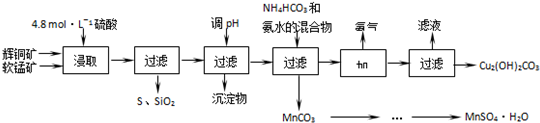
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
分析 流程分析可知辉铜矿软锰矿加入硫酸酸浸过滤得到浸出液调节溶液PH,使铁离子全部沉淀,过滤得到浸出液中主要含有CuSO4、MnSO4等,加入碳酸氢铵和氨水过滤得到混合溶液加热赶出氨气结晶析出得到碱式碳酸铜,滤渣为碳酸锰,通过蒸发浓缩,冷却结晶过滤洗涤得到硫酸锰晶体,
(1)矿石颗粒大小影响反应速率,温度升高反应加快,搅拌也可以提高浸取率;
(2)反应物是二氧化锰、硫化铜和硫酸,生成物是S、硫酸铜、硫酸锰,根据化合价升降相等配平;
(3)调节PH目的是除去Fe3+离子,根据阳离子生成氢氧化物沉淀的pH范围,选择PH范围;
(4)根据工艺流程可以看出,可循环使用的物质是氨气;
(5)晶体失去结晶水,测定硫酸锰晶体的质量分数会大于100%.
解答 解:(1)酸浸时,通过粉碎矿石或者升高温度或者进行搅拌都可以提高浸取率,故答案为:粉碎矿石(或适当升高温度或搅拌);
(2)根据化合价升降,MnO2→MnSO4化合价降低2价,
把Cu2S 当成整体,化合价升高:1×2+2=4,
所以二氧化锰化学计量数是2,氯化亚铜的计量数是1,观察法配平其它物质,
反应的化学方程式是:2MnO2+Cu2S+4H2SO4=S+2CuSO4+2MnSO4+4H2O,
故答案为:2MnO2+Cu2S+4H2SO4=S+2CuSO4+2MnSO4+4H2O;
(3)要除去滤液中的Fe3+离子,PH=3.2,Fe3+离子完全沉淀,PH=4.4,铜离子开始沉淀,故pH范围是3.2≤pH<4.4,
故答案为:3.2≤PH<4.4;使Fe3+离子转化为氢氧化铁沉淀除去;
(4)工艺流程中,加入了氨水,最后又得到了氨气,NH3 可循环使用,故答案为:NH3 ;
(5)质量分数大于100%,说明了硫酸锰晶体中可能混有不分解的硫酸盐杂质或部分硫酸锰晶体失去结晶水,故答案为:混有硫酸盐杂质或部分晶体失去结晶水.
点评 本题考查了硫酸锰和碱式碳酸铜的制取,涉及的知识点比较多,可以根据信息及所学知识,合理分析得出正确结论,本题难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 反应容器内的压强不随时间改变 | |
| B. | 反应容器内P、Q、R、S四者共存 | |
| C. | P的生成速率和S的生成速率相等 | |
| D. | 反应容器内的气体总物质的量不随时间变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室制备1,2-二溴乙烷的反应原理如下:C2H5OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O,CH2=CH2+Br2→CH2BrCH2Br,可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示.回答下列问题:
实验室制备1,2-二溴乙烷的反应原理如下:C2H5OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O,CH2=CH2+Br2→CH2BrCH2Br,可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示.回答下列问题:| 本题中出现有机物相关数据 | |||
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(B)=0.25 mol•L-1•s-1 | B. | C的体积分数为30% | ||
| C. | B的转化率为25% | D. | n=2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
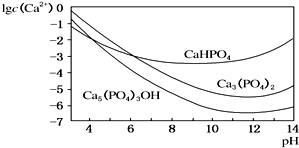 羟基磷灰石[Ca5(PO4)3OH]是一种重要的生物无机材料,其常用的制备方法有两种:
羟基磷灰石[Ca5(PO4)3OH]是一种重要的生物无机材料,其常用的制备方法有两种:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒).持续通入甲烷,在标准状况下,消耗甲烷的体积为V L.
将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒).持续通入甲烷,在标准状况下,消耗甲烷的体积为V L.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com