
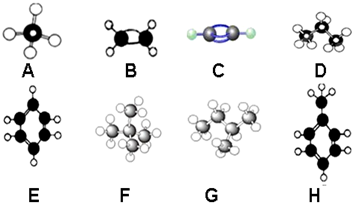
分析 根据分子球棍模型可知A为甲烷,B为乙烯,C为乙炔,D为丙烷,E为苯,F为新戊烷,G为异戊烷,H为甲苯,
(1)具有相同分子式而结构不同的化合物互为同分异构体;有机化合物中具有同一通式、组成上相差一个或多个CH2原子团、在结构与性质上相似的化合物互为同系物;苯为平面正六边形分子;
(2)新戊烷(C(CH3)4)与氯气发生一元取代反应,生成一氯新戊烷和氯化氢;
(3)碳原子连接方式多样可以是链状,也可以是环状;同种分子也可以有不同的结构.
解答 解:(1)异戊烷和新戊烷是分子式相同结构不同的化合物,所以属于同分异构体;甲苯与苯含有一个苯环,二者结构相似,分子间相差1个CH2原子团,二者都属于同系物;苯为平面正六边形分子,所有的原子共面;
故答案为:F、G;同系物;平面正六边形;
(2)新戊烷(C(CH3)4)与氯气发生一元取代反应,生成一氯新戊烷和氯化氢,方程式为:C(CH3)4+Cl2$\stackrel{光照}{→}$(CH3)3CCH2Cl+HCl;
故答案为:C(CH3)4+Cl2$\stackrel{光照}{→}$(CH3)3CCH2Cl+HCl;
(3)碳原子连接方式多样可以是链状,也可以是环状;同种分子也可以有不同的结构,即同分异构体,所以有机物种类繁多;
故答案为:碳原子连接方式多样;同分异构现象.
点评 本题考查了有机分子的球棍模型,注意考查了有机物的结构及成键特点,题目比较基础,难度不大.


科目:高中化学 来源: 题型:解答题
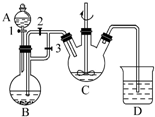 某化学兴趣小组用FeCl2(用铁粉与盐酸反应制得)和NH4HCO3制备FeCO3的装置示意图如图所示.回答下列问题:
某化学兴趣小组用FeCl2(用铁粉与盐酸反应制得)和NH4HCO3制备FeCO3的装置示意图如图所示.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol Na2O2与足量的潮湿的二氧化碳反应转移的电子数为0.1NA | |
| B. | 1mol镁与足量O2或N2反应生成MgO或Mg3N2失去电子分别为2NA和3NA | |
| C. | 含NA个Na+的Na2O2溶于1L水中,Na+的物质的量浓度为1 mol/L | |
| D. | 某密闭容器中盛有0.2molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液晶态介于晶体状态和液态之间,液晶具有一定程度的晶体的有序性和液体的流动性 | |
| B. | 常压下,0℃时冰的密度比水的密度小,水在4℃时密度最大,这些都与分子间的氢键有关 | |
| C. | 乙烯使高锰酸钾褪色和二氧化硫使溴水褪色的原理不相同 | |
| D. | 燃料的脱硫脱氮、SO2的回收利用和NOx的催化转化都是减少酸雨产生的措施 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HNO3和NH4NO3 | B. | NaOH和KCl | C. | NaN3和CaO2 | D. | AlCl3和MgCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属性逐渐增强 | |
| B. | 化合价逐渐升高 | |
| C. | 失电子能力逐渐减弱 | |
| D. | 最高价氧化物对应的水化物碱性逐渐减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2mL | 20 | / |
| Ⅱ | 2mL | 30 | / |
| Ⅲ | 1mL | 20 | 1mL蒸馏水 |
| Ⅳ | A | 20 | B |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com