
【题目】乙苯是一种用途广泛的有机原料,可制备多种化工产品。
(一)制备苯乙烯(原理如反应I所示):

(1)部分化学键的键能如下表所示:

根据反应I的能量变化,计算x= ____。
(2)工业上,在恒压设备中进行反应I时,常在乙苯蒸气中通入一定量的水蒸气。用化学平衡理论解释通入水蒸气的原因为____ 。
(3)从体系自由能变化的角度分析,反应I在____(填“高温”或“低温”)下有利于其自发进行。
(二)制备α-氯乙基苯(原理如反应II所示):

(4)T℃时,向10 L恒容密闭容器中充人2mol乙苯(g)和2 mol Cl2(g)发生反应Ⅱ,5 min时达到平衡,乙苯和Cl2、α-氯乙基苯和HCl的物质的量浓度(c)随时间(t)变化的曲线如图l所示:

①0—5 min内,以HCl表示的该反应速率v(HCl)=_____________。
②T℃时,该反应的平衡常数K=_____________。
③6 min时,改变的外界条件为_____________。
④10 min时,保持其他条件不变,再向容器中充人1moI乙苯、1 mol Cl2、1 mol α-氯乙基苯和l mol HCl,12 min时达到新平衡。在图2中画出10-12 min,Cl2和HCl的浓度变化曲线(曲线上标明Cl2和HC1);0—5 min和0—12 min时间段,Cl2的转化率分别用α1、α2表示,则αl α2(填“>”、“<”或“=”)。

【答案】(1)612
(2)该反应正向为气体分子数增大的反应,入水蒸气需增大容器容积,减小体系压强,平衡正向移动,增大反应物的转化率。
(3)高温
(4)①0.032 mol·L-1·min-1;②16;③升高温度
④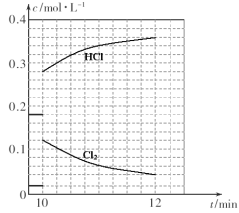 ;<
;<
【解析】
试题分析:(1)反应热=反应物总键能-生成物总能键能,由有机物的结构可知,应是-CH2CH3中总键能与-CH=CH2、H2总键能之差,设C=C键能为X,则△H=(5×412+348-3×412-X-436)kJmol-1=124kJmol-1,解得X=612KJ/mol。
故答案为:612KJ/mol;
(2)正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动,提高乙苯的平衡转化率。
故答案为:正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动,提高乙苯的平衡转化率;
(3)当△G=△H-T△S<0反应自发进行,该反应△H>0;属于分解反应,△S>0,所以在高温条件下有利于其自发进行。
故答案为:高温;
(4)①T℃时,向10L恒容密闭容器中充人2mol乙苯(g)和2mol Cl2(g),c(乙苯)=0.2mol/L,
c(Cl2)=0.2mol/L,5 min达到平衡时,c(Cl2)=0.04mol/L,△c(Cl2)=0.16mol/L,
所以v(Cl2)= △c/△t=0.16mol/L÷5min=0.032mol·L-1·min-1。
故答案为:0.032mol·L-1·min-1;
②T℃时,根据以上分析、结合反应方程式可知,达到平衡时c(Cl2)=c(Cl2)=0.04mol/L,c(HCl)=c(α-氯乙基苯)=1.6mol/L。所以,该反应的平衡常数K=![]() =
=![]() =16。
=16。
③从图像可知,6 min时,改变外界条件后,平衡向正反应方向移动,所以改变的外界条件为升高温度。
故答案为:升高温度;
④根据方程式可知,该反应前后气体分子数不变,所以10min时,保持其他条件不变,再向容器中充人1moI乙苯、1 mol Cl2、1 mol α-氯乙基苯和l molHCl,12min时达到新平衡与原平衡是等效平衡,各物质的浓度与5min时相同。因此,10-12 min,Cl2和HCl的浓度变化曲线为:
 。
。
0—5 min和0—12 min时间段,Cl2的转化率分别用α1、α2表示,则α1<α2。
故答案为: ;<。
;<。


 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:
【题目】亚硝酸氯(C1NO)是有机合成中的重要试剂。可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+C12(g)![]() 2C1NO(g),
2C1NO(g),
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
①2NO2(g)+NaC1(s)![]() NaNO3(s)+ClNO(g)K1
NaNO3(s)+ClNO(g)K1
②4NO2(g)+2NaC1(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)K2
2NaNO3(s)+2NO(g)+Cl2(g)K2
③2NO(g)+C12(g)![]() 2C1NO(g)K3
2C1NO(g)K3
则K1,K2,K3之间的关系为K3=______________。
(2)已知几种化学键的键能数据如下表(亚硝酸氯的结构为Cl-N=O):

则2NO(g)+C12(g)![]() 2C1NO(g)反应的△H和a的关系为△H=______________kJ/mol。
2C1NO(g)反应的△H和a的关系为△H=______________kJ/mol。
(3)300℃时.2NO(g)+C12(g)![]() 2ClNO(g)的正反应速率表达式为v正=k·cn(ClNO),
2ClNO(g)的正反应速率表达式为v正=k·cn(ClNO),
测得速率和浓度的关系如下表:

n=____________;k=____________(注明单位)。
(4)在1L的恒容密闭容器中充入2molNO(g)和1molC12(g),在不同温度下测得c(C1NO)与时间的关系如图A:

①该反应的△H____________0(填“>”“<”或“=”)。
②反应开始到10min时NO的平均反应速率v(NO)=____________mol/(L·min),
③T2时该反应的平衡常数K=____________
(5)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(C12)的变化图象如图B,则A、B、C三状态中,NO的转化率最大的是____________点,当n(NO)/n(C12)=1.5时,达到平衡状态ClNO的体积分数可能是D、E、F三点中的____________点。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示几种无机物之间的转换关系。其中A、B均为黑色粉末,B为非金属单质,C为无色无毒气体,D为金属单质,E是红棕色气体,G是具有漂白性的气体,H的水溶液呈蓝色。

请回答下列问题:
(1)A的化学式是 ,C的电子式是 ,Y的名称是 。
(2)反应1的化学方程式为 。
(3)19.2g的D与足量的一定浓度X的溶液反应,将所得到的气体与 LO2(标准状况下)混合,恰好能被水完全吸收。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种以黄铜矿和硫磺为原料制取铜和其他产物的新工艺,原料的综合利用率较高。其主要流程如下。请回答下列问题:
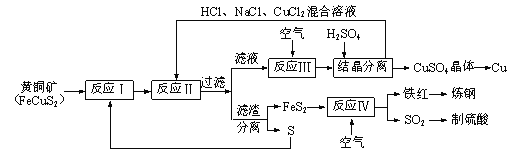
(1)反应Ⅲ的离子方程式为4CuCl2-+O2+4H+=4Cu2++8Cl-+2H2O,CuCl2-中铜元素的化合价为______,该反应中的氧化剂是___________。
(2)一定温度下,在反应Ⅲ所得的溶液中加入硫酸,可以析出硫酸铜晶体而不析出氯化铜晶体,其原因可能是____________________________________________________。
(3)炼钢时,可将铁红投入熔融的生铁中,以降低生铁的含碳量,该过程中主要反应的化学方程式是______________________________________________________________。
(4)SO2尾气直接排放到大气中造成环境污染的后果是_____________________________。
(5)已知反应Ⅱ的离子方程式为Cu2++CuS+4Cl—=2CuCl2-+S,反应Ⅰ的产物为_____________和_____________。(填化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型无机非金属材料中,氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:

请回答下列问题:
(1) 由B2O3制备BN的化学方程式是_________________________________;
(2) 基态B原子的电子排布图为________________;B和N相比,电负性较大的是__________,BN中B元素的化合价为__________;
(3) 在BF3分子中,F—B—F的键角是________, B原子的杂化轨道类型为________,BF3和过量NaF作用可生成NaBF4,BF-4的立体构型为________;
(4) 在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为___________________,层间作用力为________;
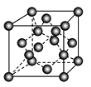
(5) 六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5 pm,立方氮化硼的一个晶胞中含有______个氮原子、________个硼原子,立方氮化硼的密度是________g·cm-3(只要求列算式,不必计算出数值,阿伏加德罗常数为NA,右图为金刚石晶胞)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜、铁、铝都是日常生活中常见的金属,具有广泛用途。请回答:
(1)铜元素在元素周期表中位于 ,其原子基态价层电子排布式为 。
(2)Cu2O的熔点比Cu2S的高,原因为 。
(3)Fe(CO)5是一种常见的配合物,可代替四乙基铅作为汽油的抗爆震剂。
①写出CO的一种常见等电子体分子的结构式 ;
两者相比较沸点较高的为 (填分子式)。
②Fe(CO)5在一定条件下发生反应:
Fe(CO)5(s)=Fe(s)+5CO(g),已知:反应过程中,断裂的化学键只有配位键,由此判断该反应所形成的
化学键类型为 。
(4)已知AlCl3·NH3有配位键。在AlCl3·NH3中,提供空轨道的原子是 ;在NH4+中N原子的杂化轨道类型为 。
(5)金属铝的晶胞结构如图甲所示,原子之间相对位置关系的平面图如图乙所示。则晶体铝中原子的堆积方式为 。已知:铝原子半径为d cm,摩尔质量为M g·mol-1,阿伏加德罗常数的值为NA,则晶体铝的密度ρ= (表达式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、某有机物的结构简式如下图所示

试回答:
(1)该有机物的分子式 ,苯环上一氯代物有 种。
(2)含有官能团的名称
(3)1mol该有机物分别与足量的H2、溴水反应需消耗H2 mol,Br2 mol
(4)该有机物与金属钠反应的化学方程式为
(5)该有机物在Cu催化下发生氧化反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】


根据实验数据求:
(1)实验完毕后,生成物中水的质量为___g。假设广口瓶里生成一种正盐,其质量为___g。
(2)生成的水中氢元素的质量为____g。
(3)生成的CO2中碳元素的质量为_____g。
(4)气态化石燃料中碳元素与氢元素的质量比为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸。依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体)。已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全。有关物质的沸点见下表:


请回答下列问题:
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为(注明反应条件)____________________________________;
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在试管A 的反应液中,目的是____________________;当试管A内的主要反应完成后温度计水银球的位置应在略低于试管A 的支管口处,目的是____________________
(3)烧杯B的作用是使试管A内的反应液均匀受热发生反应,烧杯B内盛装的液体可以是____________(在题给物质中找);
(4)若想检验试管C中是否含有产物乙酸,请你在所提供的药品中进行选择,设计一个简便的实验方案。所提供的药品有:pH试纸、红色的石蕊试纸、白色的醋酸铅试纸、碳酸氢钠粉末。实验仪器任选。该方案为_______________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com