

分析 (1)辉铜矿(主要成分是Cu2S)冶炼铜,和酸性高锰酸钾溶液反应生成铜离子,硫酸根离子,高锰酸根离子被还原为锰离子,结合原则守恒和电荷守恒配平书写;、
(2)依据溶液中氢离子物质的量和硝酸根离子物质的量,硫酸根离子物质的量,结合反应3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,中离子定量关系和元素守恒计算分析;
(3)①依据化学方程式灼烧后质量不变,反应的氧气和生成的二氧化碳和水的质量相同,结合金属生锈率=$\frac{已生锈的金属质量}{金属的总质量}$×100%,计算得到;
②依据图象书写反应过程中的热化学方程式,结合个数定量计算所需热化学方程式;
(4)①失电子的一极为负极;
②铁失电子和氢氧根离子生成高铁酸根离子和水;
③当生成19.8g的K2FeO4即0.1mol时,再根据阳极电极反应式可知转移电子为0.6mol,阴极(阴极反应为H2O得电子还原为H2和OH-)消耗0.6mol水,产生0.6molOH-进入阳极室,阴极室质量减少0.6×18g;阳极室中增加0.1molFe(5.6g),同时有O.6molOH-(5.4g)进入阳极室.
解答 解:(1)辉铜矿(主要成分是Cu2S)冶炼铜,和酸性高锰酸钾溶液反应生成铜离子,硫酸根离子,高锰酸根离子被还原为锰离子,反应的离子方程式为:Cu2S+2MnO4-+8H+=2Cu2++SO42-+2Mn2++4H2O;
故答案为:Cu2S+2MnO4-+8H+=2Cu2++SO42-+2Mn2++4H2O;
(2)某含有c(HNO3)=2mol•L-1,c(H2SO4)=4mol•L-1的废酸混合液100mL(不含其它酸或氧化剂),n(H+)=0.1L×2mol/L+0.1L×4mol/L×2=1mol,n(NO3-)=0.1L×2mol/L=0.2mol,n(SO42-)=0.1L×4mol/L=0.4mol,3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,依据定量关系可知硝酸根离子全部反应消耗氢离子0.8mol,铜0.3mol,所以生成硫酸铜晶体最多为0.3mol,最多能制备硫酸铜晶体(CuSO4•5H2O)的质量=0.3mol×250g/mol=75g;
故答案为:75g;
(3)①含有铜绿的铜片(假设不含其它杂质)在空气中灼烧至完全反应,经测定,反应前后固体的质量相同,说明反应的氧气质量和生成的二氧化碳、水蒸气的质量相同计算得到,设铜绿中铜物质的量为x,铜绿物质的量为y,
2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,
x 0.5x
Cu2(OH)2CO3$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+CO2+H2O
y y y
0.5x×32=18y+44y
x:y=31:8
依据元素守恒计算,金属生锈率=$\frac{已生锈的金属质量}{金属的总质量}$×100%=$\frac{2y×64}{(2y+x)×64}$×100%=$\frac{2×\frac{8}{31}x×64}{(2×\frac{8}{31}×+x)×64}$×100%=34%;
故答案为:34%;
②依据图象分析书写热化学方程式:①2Cu(s)+$\frac{1}{2}$O2(g)=2CuO(s)△H=-$\frac{a}{2}$KJ/mol,②2Cu2O(s)+O2(g)=4CuO(s)△H=-bKJ/mol;
依据盖斯定律计算(①×2-②)×$\frac{1}{2}$得到2Cu(s)+$\frac{1}{2}$O2(g)=Cu2O(s)△H=-($\frac{a-b}{2}$)kJ•mol-1;
故答案为:2Cu(s)+$\frac{1}{2}$O2(g)=Cu2O(s)△H=-($\frac{a-b}{2}$)kJ•mol-1;
(4)①放电时,铁失电子作负极,碳棒作正极;
故答案为:Fe;
②阳极上铁失电子和氢氧根离子反应生成高铁酸根离子和水,离子方程式为:Fe-6e-+8OH-=FeO42-+4H2O;
故答案为:Fe-6e-+8OH-=FeO42-+4H2O;
③当生成19.8g的K2FeO4即0.1mol时,再根据阳极电极反应式可知转移电子为0.6mol,阴极(阴极反应为H2O得电子还原为H2和OH-)消耗0.6mol水,产生0.6molOH-进入阳极室,阴极室质量减少0.6×18g=10.8g;阳极室中增加0.1molFe(5.6g),同时有O.6molOH-(10.2g)进入阳极室,因此阳极室质量增加5.6g+10.2g=15.8g,故膜两侧电解液的质量变化差(△m右-△m左)=15.8g-10.8g=5.0g,
故答案为:5.0.
点评 本题考查了铜及其化合物性质分析判断、热化学方程式的书写、化学方程式计算应用、原电池原理及其应用等,题目涉及的知识点较多,注意把握盖斯定律的应用方法和原电池正负极的判断、及电极方程式的书写方法,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+═SO2↑+H2O | |
| B. | 向Na2SiO3溶液中通入过量SO2:SiO32-+SO2+H2O═H2SiO3↓+SO32- | |
| C. | Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+═SO42-+3S↓+2H2O | |
| D. | 向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O═4 Na++2Cu(OH)2↓+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图中A、B、C、D、E、F、G均为有机化合物.
如图中A、B、C、D、E、F、G均为有机化合物. ;反应①的反应类型是水解反应;
;反应①的反应类型是水解反应; 中任意一种.
中任意一种.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 .
. ①、②、③3个-OH的酸性由强到弱的顺序是:
①、②、③3个-OH的酸性由强到弱的顺序是: .
.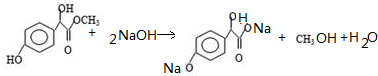 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乳酸薄荷醇酯( )仅能发生水解、氧化、消去反应 )仅能发生水解、氧化、消去反应 | |
| B. | 乙醛和丙烯醛( )不是同系物,它们与氢气充分反应后的产物也不是同系物 )不是同系物,它们与氢气充分反应后的产物也不是同系物 | |
| C. | 淀粉和纤维素在酸催化下完全水解后的产物都是葡萄糖 | |
| D. | 四联苯( )的一氯代物有4种 )的一氯代物有4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②④⑤ | C. | ②③④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过量的CO2通入NaOH溶液中:CO2+2OH-=CO32 -+H2O | |
| B. | 氨水中通入过量CO2:2NH3•H2O+CO2=2NH4++CO32-+H2O | |
| C. | 饱和碳酸氢钙溶液中加入饱和氢氧化钙溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O | |
| D. | NaHCO3溶液中加入过量的Ca(OH)2溶液:2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+CO32 - |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com