
【题目】一定条件下,在体积为3L的密闭容器中化学反应CO(g)+2H2(g)![]() CH3OH(g)达到平衡状态。
CH3OH(g)达到平衡状态。
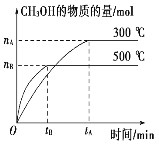
(1)该反应的平衡常数表达式K=_______;
(2)500℃时,从反应开始到达到化学平衡,以H2的浓度变化表 示的化学反应速率是______(用 nB,tB表示)。
(3)判断该可逆反应达到化学平衡状态的标志是_________(填字母,下同)。
a.v生成(CH3OH)=v消耗(CO)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变
d.CO、H2、CH3OH的浓度均不再变化
【答案】![]()
![]() cd
cd
【解析】
(1)化学平衡常数等于生成物的浓度系数次幂之积除以反应物的浓度系数次幂之积,据此书写;
(2)先根据图象,依据v=![]() 计算v(CH3OH),然后根据速率之比等于化学计量数之比求出v(H2);
计算v(CH3OH),然后根据速率之比等于化学计量数之比求出v(H2);
(3)反应到达平衡状态时,正逆反应速率相等,平衡时各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,由此进行判断,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态。
(1)化学平衡常数等于生成物的浓度系数次幂之积除以反应物的浓度系数次幂之积,则CO(g)+2H2(g)CH3OH(g)化学平衡常数k=![]() ;故答案为:
;故答案为:![]() 。
。
(2)v(CH3OH)=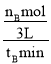 =
=![]() mol/(Lmin),化学反应中反应速率之比等于化学计量数之比,故v(H2)=2v(CH3OH)=
mol/(Lmin),化学反应中反应速率之比等于化学计量数之比,故v(H2)=2v(CH3OH)=![]() mol/(Lmin),故答案为:
mol/(Lmin),故答案为:![]() mol/(Lmin)。
mol/(Lmin)。
(3)a.v生成(CH3OH)=v消耗(CO),表示的都是正反应速率,无法判断正逆反应速率是否相等,则无法判断是否达到平衡状态,故a错误;
b.混合气体的总质量不变,容器的容积不变,混合气体的密度始终不变,混合气体的密度不再改变,不能说明到达平衡,故b错误;
c.该反应为气体体积缩小的反应,气体的物质的量发生变化,而气体总质量不变,则平均相对分子质量为变量,当平均相对分子质量不再变化时,说明达到平衡状态,故c正确;
d.平衡时各组分的浓度不变,CO、H2、CH3OH的浓度不再改变,说明到达平衡,故d正确。
故答案为:cd。


科目:高中化学 来源: 题型:
【题目】下图所示是某化学兴趣小组根据教材知识设计的能说明Na2CO3与NaHCO3热稳定性的套管实验。下列叙述中不正确的是( )
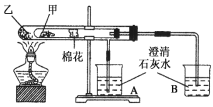
A. 甲为Na2CO3,乙为NaHCO3
B. 要证明NaHCO3受热能产生水,可在小试管内放置沾有少量无水硫酸铜粉末的棉花球
C. 加热不久就能看到B烧杯中的澄清石灰水变浑浊
D. 整个实验过程中A烧杯中的澄清石灰水无明显变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】发展煤化工是推动山西能源革命的重要力量,煤的干馏是煤化工的一种重要途径。
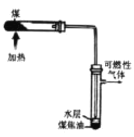
(1)煤的干馏属于_____________变化(填“物理”或“化学”)。
(2)煤干馏后得到的固体物质主要是___________,得到的可燃性气体中的一种成分是___________。
(3)煤焦油中含有苯, 用苯制硝基苯的化学方程式是_________,该反应类型属于_________。
(4)煤焦油经过分馏可以得到萘(![]() ),其分子式是_____________.
),其分子式是_____________.
(5) 为证明上图实验中得到的水层含有氨,可进行的实验操作是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中充入1 molH2和1molI2,压强为p(Pa),并在一定温度下使其发生反应H2(g)+I2(g) ![]() 2HI(g),下列说法正确的是
2HI(g),下列说法正确的是
A. 保持容器容积不变,向其中加入1molH2,化学反应速率不变
B. 保持容器容积不变,向其中加入1molAr,化学反应速率增大
C. 保持容器内气体压强不变,向其中加入1molAr,化学反应速率不变
D. 保持容器内气体压强不变,向其中加入1molH2(g)和1molI2(g),化学反应速率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【题目】一定温度下,反应N2(g)+3H2(g)![]() 2NH3(g)达到化学平衡状态的标志是
2NH3(g)达到化学平衡状态的标志是
A. c(N2):c(H2):c(NH3)=1:3:2
B. N2、H2和NH3的物质的量分数不再改变
C. N2与H2的物质的量之和是NH3的物质的量的2倍
D. 单位时间里每增加lmolN2,同时增加3molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述中,正确的是( )
A. 含20.0gNaOH的稀溶液与足量的稀硫酸完全中和,放出28.7kJ的热量,则表示中和热的热化学方程式为2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) △H=-114.8kJ·mol-1
B. 已知热化学方程式:SO2(g)+![]() O2(g)
O2(g)![]() SO3(g) △H=-98.32kJ·mol-1,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为196.64kJ
SO3(g) △H=-98.32kJ·mol-1,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为196.64kJ
C. 已知2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1,则H2的燃烧热为241.8kJ·mol-1
D. 已知石墨转化为金刚石为吸热,那么石墨比金刚石稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锌被广泛应用于医药领域和工农业生产。工业上由氧化锌矿(主要成分为ZnO,另含ZnSiO3、FeCO3、CuO等)生产ZnSO47H2O的一种流程如图:
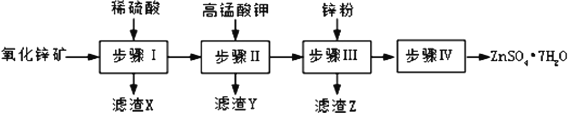
(1)步骤Ⅰ的操作是____________。
(2)步骤Ⅱ中,在pH约为5.1的滤液中加入高锰酸钾,生成Fe(OH)3和MnO(OH)2两种沉淀,该反应的离子方程式为____________________________________。
(3)步骤Ⅲ中,加入锌粉的作用是______________。
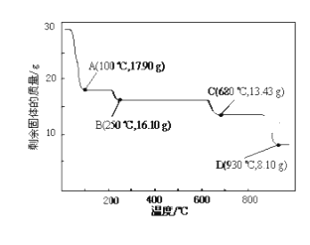
(4)取28.70 g ZnSO47H2O加热至不同温度,剩余固体的质量变化如下图所示。实验室中应置于____________(填仪器名称)焙烧样品。分析数据,100℃时发生反应的化学方程式为 ______________________________;680℃时所得固体的化学式为__________(填字母符号)。
a.ZnO b.Zn3O(SO4)2 c.ZnSO4 d.ZnSO4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将气体A、B置于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g) ![]() 2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol。
2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol。
(1)用C 表示10s内反应的平均反应速率为____________。
(2)反应前A的物质的量浓度是_______________。
(3)10s末,生成物D的浓度为______________________。
(4)A 平衡转化率______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置图及实验用品均正确的是(部分夹持仪器未画出)( )
|
|
|
|
A.实验室制取溴苯 | B.实验室制取乙酸乙酯 | C.石油分馏 | D.实验室制取硝基苯 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com