
| A、根据酸分子中含有的氢原子个数、将酸分为一元酸、二元酸和多元酸 |
| B、混合物:铝热剂、福尔马林、水玻璃、漂白粉 |
| C、根据元素原子最外层电子数的多少将元素分为金属元素和非金属元素 |
| D、明矾、水银、烧碱、硫酸均为强电解质 |


科目:高中化学 来源: 题型:
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl2通入水中:Cl2+H2O=2H++Cl-+ClO- |
| B、NaHCO3溶液中滴加盐酸:CO32-+2H+=CO2↑+H2O |
| C、钠加入水中:Na+H2O=Na++OH-+H2↑ |
| D、铜片放入HNO3稀溶液中:3Cu+8H++2NO3-=3Cu+2NO↑+4H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D |
| 分离水和四氯化碳的混合物 | 探究碳酸钠和碳酸氢钠的热稳定性 | 制取氢氧化铁胶体 | 制取并收集氨气 |
 |  |  |  |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
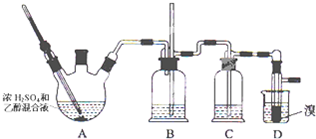
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g?cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -l30 | 9 | -1l6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com