
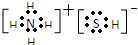 ,写出再生反应的化学方程式:2NH4HS+O2=2S↓+2NH3•H2O.NH3的沸点高于H2S,是因为NH3分子之间存在着一种比分子间作用力更强的作用力.
,写出再生反应的化学方程式:2NH4HS+O2=2S↓+2NH3•H2O.NH3的沸点高于H2S,是因为NH3分子之间存在着一种比分子间作用力更强的作用力.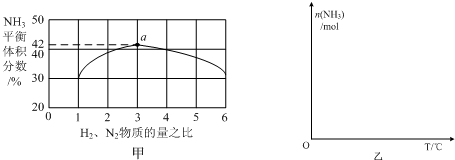
分析 (1)NH4HS为离子化合物,阴阳离子都需要标出最外层电子及所带电荷;H2S杂质常用氨水吸收,产物为NH4HS,一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,反应过程中生成一水合氨,依据原子守恒和电子守恒配平书写化学方程式;NH3分子间存在氢键,所以NH3的沸点高于H2S;
(2)硫酸氢铵中的硫氢根离子第二步电离程度Ki2=1.2×10-2,非常的大,所以硫酸氢铵溶液的酸性强同浓度的氯化铵;
(3)依据反应特征N2+3H2=2NH3,反应前后气体体积减小为生成氨气的体积,相同条件下,气体体积比等于气体物质的量之比,图象分析可知平衡状态氨气体积含量42%,设平衡混合气体体积为 100,氨气为体积42,计算反应的氮气,依据气体体积比计算原混合气体中氮气体积,得到平衡状态下氮气体积分数;
(4)合成氨的反应是放热反应,开始反应,氨气物质的量增大,达到平衡状态,继续升温,平衡逆向进行,氨气物质的量减小,据此画出变化图象;
(5)依据反应是气体体积减小的放热反应,结合平衡移动原理分析.
解答 解:(1)NH4HS为离子化合物,其电子式是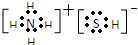 ;H2S杂质常用氨水吸收,产物为NH4HS,一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,反应过程中生成一水合氨,依据原子守恒和电子守恒配平书写化学方程式为:2NH4HS+O2=2S↓+2NH3•H2O;
;H2S杂质常用氨水吸收,产物为NH4HS,一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,反应过程中生成一水合氨,依据原子守恒和电子守恒配平书写化学方程式为:2NH4HS+O2=2S↓+2NH3•H2O;
;NH3分子间存在氢键,所以NH3的沸点高于H2S,
故答案为: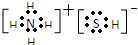 ;2NH4HS+O2=2S↓+2NH3•H2O;分子间作用;
;2NH4HS+O2=2S↓+2NH3•H2O;分子间作用;
(2)硫酸氢铵中的硫氢根离子的电离程度Ki2=1.2×10-2,0.1mol/L的硫酸氢铵溶液中氢离子浓度约为:0.1mol/L×1.2×10-2=1.2×10-3×mol/L,而氯化铵是铵根离子部分水解呈酸性,所以硫酸氢铵溶液的酸性大于同浓度的氯化铵,
故答案为:NH4HSO4;HSO4-有较大程度的电离,使溶液呈较强酸性,而NH4Cl只是NH4+水解呈弱酸性;
(3)依据反应特征N2+3H2=2NH3 △V
1 3 2 2
平衡体积 V V
即反应前后气体体积减小为生成氨气的体积,相同条件下,气体体积比等于气体物质的量之比,图象分析可知平衡状态氨气体积含量42%,设平衡混合气体体积为100,氨气为体积42,则反应前气体体积100+42=142,氮气和氢气按照1:3混合,氮气体积=142×$\frac{1}{4}$=35.5,依据化学方程式计算反应的氮气体积为21,平衡状态氮气为35.5-21=14.5,则氮气体积分数为14.5%,
故答案为:14.5%;
(4)合成氨的反应是放热反应,开始反应,氨气物质的量增大,达到平衡状态,继续升温,平衡逆向进行,氨气物质的量减小,画出的图象为: ,
,
故答案为: ;
;
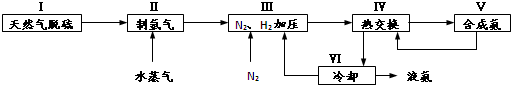
(5)分析流程合成氨放热通过Ⅳ热交换器加热反应混合气体,使反应达到所需温度,提高合成氨原料总转化率,依据平衡移动原理分析,分离出氨气促进平衡正向进行,把平衡混合气体中氮气和氢气重新循环使用,提高原理利用率;
故答案为:Ⅳ;分离液氨,未反应的氮气和氢气循环使用.
点评 本题考查了化学平衡影响因素分析、平衡计算应用,题目难度中等,注意反应特征的计算应用、图象绘制,试题侧重考查学生灵活应用基础知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 2.24L | B. | 1.12L | C. | 0.672L | D. | 0.448L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+、Mg2+、Al3+ | B. | Mg2+、Al3+、Cu2+ | C. | Fe3+、Cu2+、Zn2+ | D. | Ag+、Cu2+、Zn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
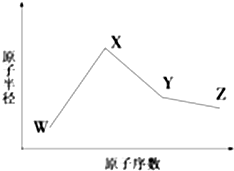 W、X、Y、Z、M、N是六种常见的短周期元素,其中W、X、Y、Z原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最强.M的原子序数比Y小1,N元素最高化合价是最低化合价绝对值的3倍.
W、X、Y、Z、M、N是六种常见的短周期元素,其中W、X、Y、Z原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最强.M的原子序数比Y小1,N元素最高化合价是最低化合价绝对值的3倍. ,
,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液态钠可用作核反应堆的传热介质 | |
| B. | 在过渡元素中找寻半导体材料 | |
| C. | 考古时利用l4C测定一些文物的年代 | |
| D. | SiO2是光导纤维的成分 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下1L0.1mol/LNH4Cl溶液与2L0.05mol/LNH4Cl溶液中c(NH4+)相等 | |
| B. | pH=5的CH3COOH溶液和pH=5的NH4NO3溶液中,c(H+)相等 | |
| C. | pH=6的CH3COOH和CH3COONa混合液中:c(Na+)+c(OH-)-c(CH3COO-)=10-6mol/L | |
| D. | pH=9的NaHA溶液中:c(Na+)>c(HA-)>c(A2-)>c(H2A)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 完成下列空白.
完成下列空白.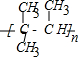 ;
; +3HNO3$→_{△}^{浓硫酸}$
+3HNO3$→_{△}^{浓硫酸}$ +3H2O.
+3H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
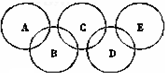 如图所示五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素;五种化合物由四种短周期元素形成,每种化合物仅含有两种元素.A是工业制取硝酸的主要原料之一;B、E分子中所含电子数都为18,B不稳定,具有较强的氧化性,E是由六个原子构成的分子,可作火箭燃料;C是工业制光导纤维的主要原料;D中所含的两种元素的原子个数之比为3:4.根据以上信息回答下列问题:
如图所示五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素;五种化合物由四种短周期元素形成,每种化合物仅含有两种元素.A是工业制取硝酸的主要原料之一;B、E分子中所含电子数都为18,B不稳定,具有较强的氧化性,E是由六个原子构成的分子,可作火箭燃料;C是工业制光导纤维的主要原料;D中所含的两种元素的原子个数之比为3:4.根据以上信息回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有②③④⑤ | B. | 只有①③④⑤ | C. | ①②③④⑤ | D. | 只有①②③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com