
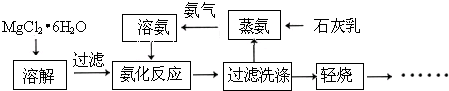
 .
.分析 氨法制取高纯镁砂的工艺流程:将氯化镁晶体溶于水,形成溶液,再加入氨水,过滤得氢氧化镁固体,氢氧化镁受热分解得氧化镁,滤液中主要含有氢化铵,向其中加入石灰乳,进行蒸氨,产生氨气溶于水得氨溶液,再循环利用,
(1)判断MgCl2溶液的酸碱性,依据镁离子存在微弱的水解,溶液呈酸性;
(2)氨分子是氮原子和三个氢原子形成三个共价键;
(3)石灰乳通入氯化铵溶液中,加热条件下石灰乳与氯化铵的反应生成氨气、氯化钙和水;
(4)分离出的氢氧化镁受热生成氧化镁和水;
(5)工业获取的MgCl2•6H2O常混有FeCl3,除去MgCl2溶液中的Fe3+,利用加入物质和酸反应调节溶液PH使铁离子全部沉淀除去;
(6)氨化反应过程是利用一水合氨和镁离子反应全部沉淀镁离子生成氢氧化镁沉淀;
(7)洗涤沉淀用蒸馏水,其操作同过滤操作,检验沉淀已洗涤干净的方法主要是检验沉淀表面是否存在氯离子.
解答 解:(1)MgCl2•6H2O溶于水,在溶液中Mg2+发生水解:Mg2++2H2O?Mg (OH)2+2H+,溶液呈酸性;
故答案为:酸性;
(2)氨分子是氮原子和三个氢原子形成三个共价键,电子式是把原子最外层电子数用小黑点标在元素符号周围,氨气的电子式为:
故答案为:
(3)将石灰乳加入氯化铵溶液中并加热产生氨气,反应的方程式为Ca(OH)2+2NH4Cl $\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CaCl2+2H2O,
故答案为:Ca(OH)2+2NH4Cl $\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CaCl2+2H2O;
(4)过滤洗涤得到Mg(OH)2固体,轻烧发生反应:Mg (OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$MgO+2H2O,所以轻烧后的产物为MgO(或氧化镁),
故答案为:MgO(或氧化镁);
(5)工业获取的MgCl2•6H2O常混有FeCl3,除去MgCl2溶液中的Fe3+,加入物质和酸反应,调节溶液PH使铁离子沉淀完全,加入的物质不能引入其他杂质;
A. MgO可以和酸反应调节PH且并不引入杂质,故A正确;
B.NaOH 可以调节溶液PH,但引入杂质钠离子,故B错误;
C.Mg(OH)2 和酸反应可以调节溶液PH且不引入新的杂质,故C正确;
D.KSCN和铁离子结合形成红色溶液不能除去铁离子,故D错误;
故选AC;
(6)溶氨后形成氨水,与MgCl2溶液发生反应生成Mg(OH)2沉淀,方程式为,Mg2++2NH3•H2O=Mg (OH)2↓+2 NH4+;
故答案为:Mg2++2NH3•H2O=Mg (OH)2↓+2 NH4+;
(7)洗涤沉淀的方法是沿玻璃棒向过滤器中滴加蒸馏水到浸没沉淀,待水自然流下,重复此操作2-3次,通过洗涤液中是否存在氯离子检验Mg(OH)2固体是否洗涤干净,方法为,向洗涤后的溶液中滴加硝酸酸化的AgNO3溶液,若无白色沉淀生成,证明已经洗涤干净;
故答案为:沿玻璃棒向过滤器中滴加蒸馏水到浸没沉淀,待水自然流下,重复此操作2-3次;向洗涤后的溶液中滴加硝酸酸化的AgNO3溶液,若无白色沉淀生成,证明已经洗涤干净.
点评 本题是工业流程题,读懂流程是关键.从流程中找到实验原理和实验目的,正确分析每一个实验步骤,题中考查的内容涉及盐类的水解、化学方程式的书写、基本实验操作、沉淀的溶解等知识点,综合性比较强.


 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| 实验编号 | 1 | 2 | 3 | 4 | 5 |
| BaCl2溶液体积/mL | 0 | 20 | 40 | 100 | 120 |
| 沉淀质量/g | 0 | 0.233 | m | 0.699 | 0.699 |
| A. | 混合前,Na2SO4溶液的物质的量浓度为0.05mol/L | |
| B. | 混合前,BaCl2溶液的物质的量浓度为0.10mol/L | |
| C. | 3号实验中沉淀的质量m为0.398g | |
| D. | 完全沉淀60mLNa2SO4溶液消耗BaCl2溶液的体积为80mL |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 氢氧化物 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
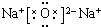 ;AB2的结构式是O=C=O.
;AB2的结构式是O=C=O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 编号 | ① | ② | ③ | ④ |
| 稀硝酸的体积/mL | 100 | 200 | 300 | 400 |
| 剩余金属的质量/g | 18.0 | 9.6 | 0 | 0 |
| NO 的体积/mL | 2240 | 4480 | 6720 | V |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 元素代号 | A | B | C | D | E | F | G |
| 原子半径/nm | 0.037 | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 | 0.075 |
| 主要化合价 | +1 | +2 | +3 | +6、-2 | -1 | -2 | +5、-3 |
 ;
; NH4++NH2-.
NH4++NH2-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检查病人胃病所用的钡餐,只能用BaSO4,不可以用BaCO3 | |
| B. | 为了使馒头、银耳等洁白、卖相好,可以用点燃硫磺法熏蒸它们 | |
| C. | 可以用SO2来漂白纸浆、毛、丝、草帽辫等 | |
| D. | “硫磺”温泉可以医治皮肤病 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com