
����Ŀ����λ���������ṹ������������������ѧϰԪ�������ɵ���Ҫ˼·��
��1�����ǿ��Ը���ԭ�ӽṹʾ��ͼ���Ʋ�Ԫ�������ڱ��е�λ�ã�����ΪXԪ�ص�ԭ�ӽṹʾ��ͼ(δ��ȫ)��
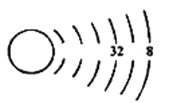
��д��XԪ�������ڱ��е�λ��_____________________��
��2������Ҳ���Ը������������Ʋ��Ԫ����Ԫ�����ڱ��е�λ�ã���YԪ�����������ȿ�������Ũ���ᣬҲ��������NaOH��Һ��������������Ӧ��ˮ����ȿ������ᷴӦ��Ҳ������Ӧ��1mol��Ԫ������������Ӧ��ˮ�����������ᷴӦʱ�����������4molHCl����д��YԪ�������ڱ��е�λ��_____________________��
��3����������֪����Ԫ�ص�λ�ù�ϵ�����ǿ����Ʋ�Ԫ�����ʻ���Ԫ�ض�Ӧ�ĵ��ʼ�����������ʡ����ֶ�����Ԫ�������ڱ��е�λ������ͼ��ʾ������ֻ��MΪ����Ԫ�ء���Y��Zԭ�Ӱ뾶�������____����Ԫ�ط��Ż�ѧʽ����ͬ����Y��X����������Ӧˮ��������Ը�������______��
���𰸡���������0�� ����������A�� C H2SiO3
��������
(1)��Ԫ����6�����Ӳ㣬��Ϊ�������ڣ�����������Ϊ8����Ϊ0��Ԫ�أ�����XԪ�������ڱ��е�λ��Ϊ��������0�壻
(2)������Ŀ��Ϣ��֪��Ԫ�ص���������������������ˮ����Ϊ�������ʣ����ݶԽ��߹���Ԫ��Ӧ��λ��AlԪ�ص����Ϸ��������·���1mol��Ԫ������������Ӧ��ˮ�����������ᷴӦʱ�����������4molHCl�����Ԫ������������Ӧ��ˮ����ΪY(OH)4����Ԫ���������Ϊ+4�ۣ����Ԫ��Ӧ��λ�ڵ���A�壬�ۺϷ�����֪YԪ��λ�ڵ���������A�壻
(3)����Ԫ�����ڱ��ж����ڲ��ֵĽṹ��Ԫ��λ�ÿ�֪��Y��Zλ�ڵڶ����ڣ�M��Xλ�ڵ������ڣ�������������MΪ����Ԫ�ء�XΪ�ǽ���Ԫ�أ������MΪAl��XΪSi���Ӷ��ƶϳ�YΪC��ZΪN��ͬ����������ԭ�Ӱ뾶��С������C��ԭ�Ӱ뾶����ͬ����Ԫ�����϶��·ǽ����Լ��������Էǽ�����C>Si������H2SiO3���Ը�����


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ�������й���������ȷ����(����)
A. ��״���£�1L������ȫȼ�������ɵ���̬����ķ�����Ϊ(7/22.4)NA
B. 1 mol��(��CH3)�����ĵ�������Ϊ9NA
C. 0.5 mol1��3������ϩ�����к���̼̼˫����ΪNA
D. 1 mol̼������(CH3+)�����ĵ�������Ϊ8NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���в�ҩ��Ƥ�к��е���Ҷ��������ÿ���۵��ʾһ��̼ԭ�ӣ���ԭ��δ�����������п�������.��1mol��Ҷ�������ֱ���Ũ��ˮ��NaOH��Һ��ȫ��Ӧ�������ĵ�Br2��NaOH�����ʵ����ֱ�Ϊ�� ��
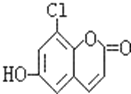
A.2molBr2��2molNaOHB.3molBr2��4molNaOH
C.3molBr2��5molNaOHD.4molBr2��5molNaOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��W��Ϊ������Ԫ�أ�������Ԫ�����ڱ��е�λ����ͼ��ʾ����Yԭ�ӵ����ڲ��������������������1/3������˵������ȷ����
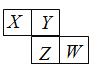
A.Y��ZԪ�ص�������۾�Ϊ+6��
B.X��YԪ���γɵĻ������Ϊ����������
C.����������Ӧˮ��������ԣ�W>Z
D.W������������������Һ��Ӧ������һ�־���Ư���Ե�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���l0mL0.1mol/L��HR��Һ������0.lmol/L��NH3��H2O ��Һ��������ҺpH�������Ա仯��ͼ�����з�������ȷ����

A. ab�㵼��������ǿ��˵��HRΪ����
B. b����Һ��c(NH3H2O)=c(R-)+c(H+)-c(OH-)
C. c����Һ������c(NH4+)>c(R-)>c(OH-)>c(H+)
D. �����£�HR��NH3H2O�ĵ���ƽ�ⳣ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��W��X��Y��Z��ԭ�������������ӣ�����ЩԪ����ɵij������ʵ�ת����ϵ����ͼ������a��b��d��gΪ��������aΪ����ɫ������c��Z�ĵ������õ������ˮ������Ӧ���Ҹõ��ʿ�������������fΪ���嵥�ʡ������й�˵����ȷ����
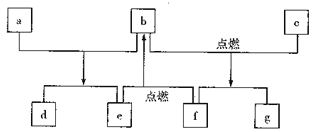
A. �����ӵİ뾶:Y>Z>X B. Ԫ�صķǽ�����:W>X
C. ����������Ӧˮ����ļ���:Y>Z D. X��Y����Ԫ����ɵĻ�����ֻ�����Ӽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��6g̼����ȫȼ�����ò����У�CO��CO2�������Ϊ2��3���ң�C(s)+O2(g)=CO(g) ��H=-110.35kJ��mol-1 CO(g)+O2(g)=CO2(g) ��H=-282.57 kJ��mol-1����6g̼��ȫȼ����ȣ���ʧ������Ϊ�� ��
A.56.51kJB.110.35kJC.196.46kJD.282.57kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NH4Al(SO4)2��ʳƷ�ӹ�����Ϊ��ݵ�ʳƷ���Ӽ������ڱ���ʳƷ�У�NH4HSO4�ڷ����Լ���ҽҩ�����ӹ�ҵ����;�㷺����ش��������⣺
(1)��ͬ�����£�0.1mol/L NH4Al(SO4)2��c(NH4+) ______ ![]() ������������������������С����0.1mol/LNH4HSO4��c(NH4+)��
����������������������������0.1mol/LNH4HSO4��c(NH4+)��
(2)��ͼ��0.1mol/L�������Һ��pH���¶ȱ仯��ͼ��
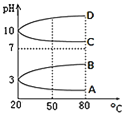
�����з���0.1mol/L NH4Al(SO4)2��pH���¶ȱ仯�������� ______ (��д��ĸ)��
��20��ʱ��0.1mol/L NH4Al(SO4)2��2c(SO42-)-c(NH4+)-3c(Al3+)=______mol/L
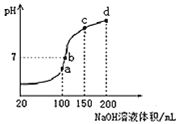
(3)����ʱ����100mL0.1mol/LNH4HSO4��Һ�еμ�0.1mol/LNaOH��Һ���õ�����ҺpH��NaOH��Һ����Ĺ�ϵ������ͼ��ʾ���Է���ͼ��a��b��c��d�ĸ��㣬ˮ�ĵ���̶������� ______ ����b�㣬��Һ�и�����Ũ���ɴ�С������˳���� ______
(4)��֪Al(OH)3Ϊ������(�����£�Ksp[Al(OH)3]=2.0��10-33)����ҺpH=5ʱ��ij��Һ�е�Al3+ ______ ![]() ������������������
������������������![]() ��ȫ����(��Һ�е�����Ũ��С��1��10-5mol/Lʱ��������ȫ)
��ȫ����(��Һ�е�����Ũ��С��1��10-5mol/Lʱ��������ȫ)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1��2����������������Ϳ����������Ӽ���������������ɫҺ�壬������ˮ�������ڴ����л��ܼ���ʵ�����Ʊ�1��2����������ķ�Ӧԭ�����£�
CH3CH2OH![]() CH2=CH2+H2O
CH2=CH2+H2O
CH2=CH2+Br2��BrCH2CH2Br
��֪�����Ҵ���Ũ�����������140����ˮ��������
2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
��ʵ���г����¶ȹ��߶�ʹ�Ҵ���Ũ���ᷴӦ��������SO2��CO2����12.0g����������Ҵ��Ʊ�1��2-�������飬ʵ��װ����ͼ��ʾ��
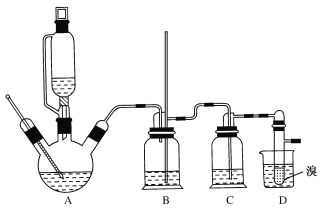
�й������б����£�
��� | �Ҵ� | 1��2-�������� | ���� |
״̬ | ��ɫҺ�� | ��ɫҺ�� | ��ɫҺ�� |
�ܶ�/g��cm-3 | 0.79 | 2.2 | 0.71 |
�е�/�� | 78.5 | 132 | 34.6 |
�۵�/�� | -130 | 9 | -116 |
�ش��������⣺
��1���ڴ��Ʊ�ʵ���У�A�а���������3�s1�����Ҵ���Ũ�����A�л�Ҫ���뼸�����Ƭ����������___��Ҫ������Ѹ�ٵذѷ�Ӧ�¶���ߵ�170�����ң�������ҪĿ����___��
��2��װ��B������������ȫƿ��ƿ��ʢˮ�����˿��Է�ֹ�������⣬�����ж�װ���Ƿ��������������B��������____��
��3����װ��C��Ӧ����NaOH��Һ����Ŀ����____��
��4��װ��D��С�Թ���ʢ��Һ�壬�жϸ��Ʊ���Ӧ�Ѿ��������������___��
��5����1��2����������ֲ�Ʒ���ڷ�Һ©���м�ˮ�����ã�����Ӧ��___��(����������������)����������������δ��Ӧ��Br2�������___ϴ�ӳ�ȥ�������������������������ѣ�����____��������������ƣ��ķ�����ȥ��
��6����Ӧ������Ӧ����ˮ��ȴװ��D������ҪĿ������ϩ���巴Ӧʱ���ȣ���ȴ�ɱ�����Ĵ����ӷ������ֲ��ܹ�����ȴ(���ñ�ˮ)����ԭ����___��
��7����ʵ�������õ�9.4g��Ʒ��1��2����������IJ���Ϊ___��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com