
分析 (1)平衡时c(D)=$\frac{0.8mol}{2L}$=0.4mol/L,同一可逆反应中同一段时间内化学反应速率之比=计量数之比=$\frac{△c(C)}{△t}$:$\frac{△c(D)}{△t}$;
(2)根据方程式知,生成n(D)与参加反应的n(A)之比=2:3,生成n(D)=0.8mol,则参加反应的n(A)=$\frac{3}{2}$×n(D)=$\frac{3}{2}$×0.8mol=1.2mol,A的转化率=$\frac{参加反应的n(A)}{反应初始n(A)}$×100%;
(3)根据方程式知,生成n(D)与参加反应的n(B)之比=2:1,生成n(D)=0.8mol,则参加反应的n(B)=$\frac{1}{2}$×n(D)=$\frac{1}{2}$×0.8mol=0.4mol,剩余n(B)=(2-0.4)mol=1.6mol,平衡时c(B)=$\frac{△n}{V}$.
解答 解:(1)平衡时c(D)=$\frac{0.8mol}{2L}$=0.4mol/L,同一可逆反应中同一段时间内化学反应速率之比=计量数之比=$\frac{△c(C)}{△t}$:$\frac{△c(D)}{△t}$,c(C):c(D)=0.4mol/L:0.4mol/L=1:1,所以x=2,
故答案为:2;
(2)根据方程式知,生成n(D)与参加反应的n(A)之比=2:3,生成n(D)=0.8mol,则参加反应的n(A)=$\frac{3}{2}$×n(D)=$\frac{3}{2}$×0.8mol=1.2mol,A的转化率=$\frac{参加反应的n(A)}{反应初始n(A)}$×100%=$\frac{1.2mol}{2mol}$×100%=60%,
故答案为:60%;
(3)根据方程式知,生成n(D)与参加反应的n(B)之比=2:1,生成n(D)=0.8mol,则参加反应的n(B)=$\frac{1}{2}$×n(D)=$\frac{1}{2}$×0.8mol=0.4mol,剩余n(B)=(2-0.4)mol=1.6mol,平衡时c(B)=$\frac{△n}{V}$=$\frac{1.6mol}{2L}$=0.8mol/L,
故答案为:0.8.
点评 本题考查化学平衡计算,为高频考点,侧重考查学生分析计算能力,明确化学方程式中各个物理量的关系式是解本题关键,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
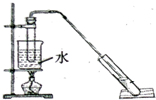 “酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯.某兴趣小组用无水乙醇和冰醋酸制备乙酸乙酯,相关物质的数据如下:
“酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯.某兴趣小组用无水乙醇和冰醋酸制备乙酸乙酯,相关物质的数据如下:| 物质 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 分子量 | 46 | 60 | 88 |
| 沸点(℃) | 78.5 | 117.9 | 77.1 |
| 密度(g/cm3) | 0.789 | 1.05 | 0.90 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO分解反应NO(g)?$\frac{1}{2}$N2(g)+$\frac{1}{2}$O2(g)的平衡常数为1×10-30 | |
| B. | 根据K2的值可以判断常温下H2和O2很容易反应生成H2O | |
| C. | 常温下,NO、H2O、CO2三种物质分解放出O2的倾向顺序为NO>H2O>CO2 | |
| D. | 温度升高,上述三个反应的平衡常数均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol KClO3所具有的总能量高于1 mol KCl所具有的总能量 | |
| B. | KClO3分解速率快慢主要取决于反应① | |
| C. | 1 g KClO3,1 g MnO2,0.1 g Mn2O7混合加热,充分反应后MnO2质量为1 g | |
| D. | 将固体二氧化锰碾碎,可加快KClO3的分解速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入硝酸酸化,再滴加KSCN溶液后有红色物质生成,则原溶液中一定有Fe3+存在 | |
| B. | 加入盐酸有能使澄清石灰水变浑浊的气体生成,则原溶液中一定有大量的CO32-存在 | |
| C. | 某溶液做焰色反应时火焰为黄色,则该溶液中一定有钠元素 | |
| D. | 分别含有Mg2+、Cu2+、Fe2+和Na+的四种盐溶液,只用NaOH溶液不能一次性鉴别开 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 产物不稳定,受热即脱水而生成不饱和醛.
产物不稳定,受热即脱水而生成不饱和醛.
 ;F
;F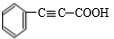 .
. +CH3CHO$\stackrel{△}{→}$
+CH3CHO$\stackrel{△}{→}$ +H2OE→F
+H2OE→F +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$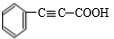 +2NaBr+2H2O
+2NaBr+2H2O查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com