
 +CH3CHO$\stackrel{NaOH溶液}{→}$
+CH3CHO$\stackrel{NaOH溶液}{→}$ +H2O
+H2O| A. | ①②⑤ | B. | ③④⑤ | C. | ④⑤⑥ | D. | ②⑤⑦ |
分析 A为苯甲醛,含有醛基,可发生氧化和还原反应,含有苯环,可发生取代反应,B为肉桂醛,分子中含有碳碳双键,可发生加成、加聚和氧化反应,含有醛基,可发生加成、还原和氧化反应,结合有机物结构简式判断分子式,结合苯、乙烯、甲醛的结构判断有机物的空间结构.
解答 解:①对比A、B的结构可知,B的相对分子质量比A大26,故错误;
②A、B都含有醛基,可被高锰酸钾氧化,不能用酸性高锰酸钾溶液鉴别,故错误;
③B中含有的官能团是醛基、碳碳双键,故正确;
④A、B都含有醛基,能发生加成反应、还原反应,故正确;
⑤A含有醛基,能发生银镜反应,故正确;
⑥B的同类同分异构体(含苯环、包括B)分为两类,一类是苯环上含有CH2=CH-和-CHO,有邻、间、对3种,另一类为苯环只含有1个侧链,有两种位置异构,共有5种,故错误;
⑦A中苯环和-CHO为σ键,可旋转,不一定在同一个平面上,故错误.
故选B.
点评 本题考查有机物的结构和性质,为高考常见题型,侧重于考查学生的分析能力和综合运用化学知识的能力,注意把握官能团的性质以及有机物的空间结构,为解答该题的易错点.


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:解答题
 醋酸是日常生活中常见的弱酸.
醋酸是日常生活中常见的弱酸.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丁醛 | B. | 正丁醛的同系物 | ||
| C. | CH3CH2COCH3 (2-丁酮) | D. | CH2=C(CH3)CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:
中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:| 温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差 平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | 3.4℃ |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.6mol/L | B. | 1mol/L | C. | 1.2mol/L | D. | 0.5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6L | B. | 6.72L | C. | 8.4L | D. | 2.8L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )具有高度对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点.下面是立方烷衍生物I的一种合成路线:
)具有高度对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点.下面是立方烷衍生物I的一种合成路线: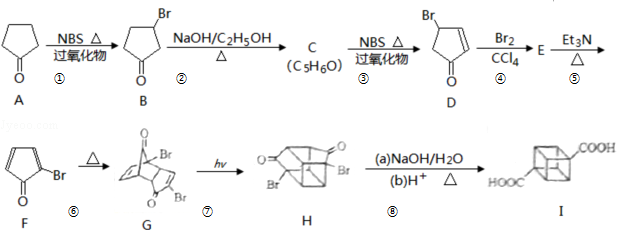
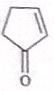 .
. $\stackrel{反应1}{→}$X$\stackrel{反应2}{→}$Y$\stackrel{反应3}{→}$
$\stackrel{反应1}{→}$X$\stackrel{反应2}{→}$Y$\stackrel{反应3}{→}$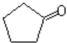 反应I的试剂与条件为Cl2/光照,反应2的化学方程式为
反应I的试剂与条件为Cl2/光照,反应2的化学方程式为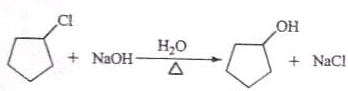 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com