
族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | ① | |||||||
| 二 | ② | ③ | ④ | ⑤ | ||||
| 三 | ⑥ | ⑦ | ⑧ | ⑨ | ||||


 ,故答案为:
,故答案为: ;
;

 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:

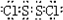
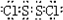

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:
下图是依各个原子的性质和原子序数(1~20)画的关系图,各图的纵轴可能代表下列的某一性质:质量数、质子数、最高正价、原子半径相对大小、得电子相对能力。图2中原子序数8、9和图3中原子序数2、10、18在纵轴上没有对应的数值。

(1)图1~图3的纵轴分别代表__________、__________、__________;
(2)已知aA、bB、cC、dD、eE、gG六种元素原子序数依次增大,原子半径按A、E、D、C、B、G的顺序增大,它们分散在三个短周期中。B是生命体的构架元素,E是同周期中半径最小的元素,G的最外层电子数比次外层电子数少2个。它们的原子序数存在如下关系:①a+b=c,②(b+d)/2=c,③(c+e)/2=d,请根据提供的信息,回答下列问题:
下图是元素周期表前三周期的边界,请将A~G六种具体元素符号填在表中相应的位置;

②写出铜与C元素最高价氧化物对应水化物的浓溶液反应的化学 方程_______________;
③X、Y、Z、W是仅由上述元素组成的四种物质,且有如下转化关系:
X+Y―→Z+W。若X为单质,Y、Z、W均为化合物,且该反应是重要的工业生产反应,其相应的化学方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年福建省晋江市季延中学高二上学期期末考试化学试卷(带解析) 题型:单选题
四种短周期元素的性质或结构信息如下表。下列推断错误的是
| 元素编号 | 元素性质或结构 |
| T | M层上有2对成对电子 |
| X | 元素最高正价是+7价 |
| Y | 第三周期元素的简单离子中半径最小 |
| Z | 单质是银白色固体、导电、密度比水小,与水剧烈反应、和氧气反应不同条件下产物不同 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年北京市房山区房山中学高一下学期期中考试化学试卷(带解析) 题型:单选题
下表为部分短周期元素的原子半径及主要化合价,根据表中信息判断,下列叙述正确的是
| 元素代号 | X | Y | Z | M | N |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.071 | 0.099 |
| 主要化合价 | +2 | +3 | +6、-2 | -1 | -1 |
查看答案和解析>>
科目:高中化学 来源:2012届山东省兖州市高二下学期期中考试化学试卷 题型:选择题
已知X、Y是主族元素,下表中I为电离能,单位是kJ/mol。下列判断错误的是
|
元素 |
I1 |
I2 |
I3 |
I4 |
|
X |
500 |
4600 |
6900 |
9500 |
|
Y |
580 |
1800 |
2700 |
11600 |
A.元素X的常见化合价是+1价
B.元素Y是ⅢA族的元素
C.元素X与氯形成化合物时,化学式可能是XCl
D.若元素Y处于第3周期,它可与冷水剧烈反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com